+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7ut7 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | C2 symmetric cryoEM structure of Azotobacter vinelandii MoFeP under non-turnover conditions | |||||||||||||||
 要素 要素 | (Nitrogenase molybdenum-iron protein ...) x 2 | |||||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / nitrogenase / MoFeP / nitrogen fixation | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報molybdenum-iron nitrogenase complex / nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / ATP binding / metal ion binding 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Azotobacter vinelandii DJ (窒素固定) Azotobacter vinelandii DJ (窒素固定) | |||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 1.91 Å | |||||||||||||||
 データ登録者 データ登録者 | Rutledge, H.L. / Cook, B.D. / Tezcan, F.A. / Herzik, M.A. | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Science / 年: 2022 ジャーナル: Science / 年: 2022タイトル: Structures of the nitrogenase complex prepared under catalytic turnover conditions. 著者: Hannah L Rutledge / Brian D Cook / Hoang P M Nguyen / Mark A Herzik / F Akif Tezcan /  要旨: The enzyme nitrogenase couples adenosine triphosphate (ATP) hydrolysis to the multielectron reduction of atmospheric dinitrogen into ammonia. Despite extensive research, the mechanistic details of ...The enzyme nitrogenase couples adenosine triphosphate (ATP) hydrolysis to the multielectron reduction of atmospheric dinitrogen into ammonia. Despite extensive research, the mechanistic details of ATP-dependent energy transduction and dinitrogen reduction by nitrogenase are not well understood, requiring new strategies to monitor its structural dynamics during catalytic action. Here, we report cryo-electron microscopy structures of the nitrogenase complex prepared under enzymatic turnover conditions. We observe that asymmetry governs all aspects of the nitrogenase mechanism, including ATP hydrolysis, protein-protein interactions, and catalysis. Conformational changes near the catalytic iron-molybdenum cofactor are correlated with the nucleotide-hydrolysis state of the enzyme. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7ut7.cif.gz 7ut7.cif.gz | 404.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7ut7.ent.gz pdb7ut7.ent.gz | 325.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7ut7.json.gz 7ut7.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ut/7ut7 https://data.pdbj.org/pub/pdb/validation_reports/ut/7ut7 ftp://data.pdbj.org/pub/pdb/validation_reports/ut/7ut7 ftp://data.pdbj.org/pub/pdb/validation_reports/ut/7ut7 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  26757MC  7ut6C  7ut8C  7ut9C  7utaC  8dpnC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Nitrogenase molybdenum-iron protein ... , 2種, 4分子 ACBD
| #1: タンパク質 | 分子量: 55363.043 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Azotobacter vinelandii DJ (窒素固定) / 参照: UniProt: P07328, nitrogenase Azotobacter vinelandii DJ (窒素固定) / 参照: UniProt: P07328, nitrogenase#2: タンパク質 | 分子量: 59535.879 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Azotobacter vinelandii DJ (窒素固定) / 参照: UniProt: C1DGZ8, nitrogenase Azotobacter vinelandii DJ (窒素固定) / 参照: UniProt: C1DGZ8, nitrogenase |
|---|
-非ポリマー , 5種, 423分子 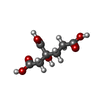
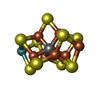



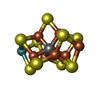



| #3: 化合物 | | #4: 化合物 | #5: 化合物 | #6: 化合物 | #7: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Heterotetrameric MoFeP from Azotobacter vinelandii / タイプ: COMPLEX 詳細: Wild-type MoFeP was purified from the native organism, Azotobacter vinelandii Entity ID: #1-#2 / 由来: NATURAL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.23321 MDa / 実験値: NO | |||||||||||||||
| 由来(天然) | 生物種:  Azotobacter vinelandii DJ (窒素固定) Azotobacter vinelandii DJ (窒素固定) | |||||||||||||||
| 緩衝液 | pH: 8 詳細: Solutions were prepared and filtered immediately prior to the experiment. | |||||||||||||||
| 緩衝液成分 |
| |||||||||||||||
| 試料 | 濃度: 1.44 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: UltrAuFoil R1.2/1.3 | |||||||||||||||
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE-PROPANE / 湿度: 95 % / 凍結前の試料温度: 277 K / 詳細: Custom manual plunger. Greater than 95% humidity. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 165000 X / 最大 デフォーカス(公称値): 1500 nm / 最小 デフォーカス(公称値): 500 nm / Cs: 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: ZEMLIN TABLEAU |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 123 K / 最低温度: 93 K |
| 撮影 | 電子線照射量: 65 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 2 / 実像数: 3773 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING ONLY | ||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2628629 | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 1.91 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 177123 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj




