+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7t9x | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Saccharomyces cerevisiae Pex12 RING domain | ||||||
 要素 要素 | Peroxisome assembly protein 12 | ||||||
 キーワード キーワード | LIGASE / Saccharomyces cerevisiae Pex12 RING domain | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / Class I peroxisomal membrane protein import / peroxisomal importomer complex / protein import into peroxisome matrix / Peroxisomal protein import / : / E3 ubiquitin ligases ubiquitinate target proteins / protein monoubiquitination / ubiquitin ligase complex / ubiquitin-protein transferase activity ...: / Class I peroxisomal membrane protein import / peroxisomal importomer complex / protein import into peroxisome matrix / Peroxisomal protein import / : / E3 ubiquitin ligases ubiquitinate target proteins / protein monoubiquitination / ubiquitin ligase complex / ubiquitin-protein transferase activity / ubiquitin protein ligase activity / protein ubiquitination / zinc ion binding 類似検索 - 分子機能 | ||||||
| 生物種 | Bacteria (unknown) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / AB INITIO PHASING / 解像度: 1.52 Å シンクロトロン / AB INITIO PHASING / 解像度: 1.52 Å | ||||||
 データ登録者 データ登録者 | Feng, P. / Rapoport, T. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: A peroxisomal ubiquitin ligase complex forms a retrotranslocation channel. 著者: Peiqiang Feng / Xudong Wu / Satchal K Erramilli / Joao A Paulo / Pawel Knejski / Steven P Gygi / Anthony A Kossiakoff / Tom A Rapoport /  要旨: Peroxisomes are ubiquitous organelles that house various metabolic reactions and are essential for human health. Luminal peroxisomal proteins are imported from the cytosol by mobile receptors, which ...Peroxisomes are ubiquitous organelles that house various metabolic reactions and are essential for human health. Luminal peroxisomal proteins are imported from the cytosol by mobile receptors, which then recycle back to the cytosol by a poorly understood process. Recycling requires receptor modification by a membrane-embedded ubiquitin ligase complex comprising three RING finger domain-containing proteins (Pex2, Pex10 and Pex12). Here we report a cryo-electron microscopy structure of the ligase complex, which together with biochemical and in vivo experiments reveals its function as a retrotranslocation channel for peroxisomal import receptors. Each subunit of the complex contributes five transmembrane segments that co-assemble into an open channel. The three ring finger domains form a cytosolic tower, with ring finger 2 (RF2) positioned above the channel pore. We propose that the N terminus of a recycling receptor is inserted from the peroxisomal lumen into the pore and monoubiquitylated by RF2 to enable extraction into the cytosol. If recycling is compromised, receptors are polyubiquitylated by the concerted action of RF10 and RF12 and degraded. This polyubiquitylation pathway also maintains the homeostasis of other peroxisomal import factors. Our results clarify a crucial step during peroxisomal protein import and reveal why mutations in the ligase complex cause human disease. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7t9x.cif.gz 7t9x.cif.gz | 82.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7t9x.ent.gz pdb7t9x.ent.gz | 51.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7t9x.json.gz 7t9x.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7t9x_validation.pdf.gz 7t9x_validation.pdf.gz | 853.2 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7t9x_full_validation.pdf.gz 7t9x_full_validation.pdf.gz | 853.2 KB | 表示 | |
| XML形式データ |  7t9x_validation.xml.gz 7t9x_validation.xml.gz | 7.9 KB | 表示 | |
| CIF形式データ |  7t9x_validation.cif.gz 7t9x_validation.cif.gz | 10.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/t9/7t9x https://data.pdbj.org/pub/pdb/validation_reports/t9/7t9x ftp://data.pdbj.org/pub/pdb/validation_reports/t9/7t9x ftp://data.pdbj.org/pub/pdb/validation_reports/t9/7t9x | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7t92C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 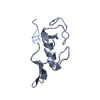
| ||||||||||||||||||
| 2 | 
| ||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Component-ID: 1 / Ens-ID: 1 / Beg auth comp-ID: PRO / Beg label comp-ID: PRO / End auth comp-ID: ILE / End label comp-ID: ILE / Auth seq-ID: 2 - 74 / Label seq-ID: 1 - 73
|
- 要素
要素
| #1: タンパク質 | 分子量: 8008.321 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現) Bacteria (unknown) / 遺伝子: PEX12, YMR026C, YM9711.16C / 発現宿主: Bacteria (unknown) / 参照: UniProt: Q04370 #2: 化合物 | #3: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.02 Å3/Da / 溶媒含有率: 39.07 % |
|---|---|
| 結晶化 | 温度: 291.15 K / 手法: 蒸発脱水法 詳細: 0.1 M bis-Tris propane, pH 8.5, 0.2 M sodium fluoride, 20% PEG3350 |
-データ収集
| 回折 | 平均測定温度: 293 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 24-ID-C / 波長: 0.967 Å / ビームライン: 24-ID-C / 波長: 0.967 Å |
| 検出器 | タイプ: ADSC QUANTUM 315 / 検出器: CCD / 日付: 2019年6月13日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.967 Å / 相対比: 1 |
| 反射 | 解像度: 1.52→71.22 Å / Num. obs: 34282 / % possible obs: 97.1 % / 冗長度: 9.3 % / Biso Wilson estimate: 13.62 Å2 / Rmerge(I) obs: 0.057 / Net I/σ(I): 36.1 |
| 反射 シェル | 解像度: 1.52→4.8 Å / Rmerge(I) obs: 0.057 / Num. unique obs: 18534 / CC1/2: 0.772 / % possible all: 83.8 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.17.1_3660 / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法: AB INITIO PHASING / 解像度: 1.52→71.22 Å / SU ML: 0.127 / 交差検証法: FREE R-VALUE / σ(F): 1.44 / 位相誤差: 20.5963 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 17.8 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.52→71.22 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Origin x: 4.30503115124 Å / Origin y: 9.56719701048 Å / Origin z: 55.2594773437 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ | Selection details: all |
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj




