+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7f0d | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Mycobacterium tuberculosis 50S ribosome subunit bound with clarithromycin | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | RIBOSOME / Mycobacterium tuberculosis / 50S ribosomal subunit / gate site A2062 / clarithromycin / dynamic interaction / Cryo-EM / drug resistance | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報large ribosomal subunit / transferase activity / 5S rRNA binding / ribosomal large subunit assembly / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding ...large ribosomal subunit / transferase activity / 5S rRNA binding / ribosomal large subunit assembly / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding / structural constituent of ribosome / ribosome / translation / ribonucleoprotein complex / mRNA binding / metal ion binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Mycobacterium tuberculosis H37Ra (結核菌) Mycobacterium tuberculosis H37Ra (結核菌) | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||||||||
 データ登録者 データ登録者 | Zhang, W. / Sun, Y. / Gao, N. / Li, Z. | ||||||||||||
| 資金援助 |  中国, 3件 中国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Emerg Microbes Infect / 年: 2022 ジャーナル: Emerg Microbes Infect / 年: 2022タイトル: Cryo-EM structure of 50S ribosomal subunit bound with clarithromycin reveals dynamic and specific interactions with macrolides. 著者: Wen Zhang / ZhiFei Li / Yufan Sun / Peng Cui / Jianhua Liang / Qinghe Xing / Jing Wu / Yanhui Xu / Wenhong Zhang / Ying Zhang / Lin He / Ning Gao /  要旨: Tuberculosis (TB) is the leading infectious disease caused by (). Clarithromycin (CTY), an analog of erythromycin (ERY), is more potent against multidrug-resistance (MDR) TB. ERY and CTY were ...Tuberculosis (TB) is the leading infectious disease caused by (). Clarithromycin (CTY), an analog of erythromycin (ERY), is more potent against multidrug-resistance (MDR) TB. ERY and CTY were previously reported to bind to the nascent polypeptide exit tunnel (NPET) near peptidyl transferase center (PTC), but the only available CTY structure in complex with () ribosome could be misinterpreted due to resolution limitation. To date, the mechanism of specificity and efficacy of CTY for remains elusive since the ribosome-CTY complex structure is still unknown. Here, we employed new sample preparation methods and solved the ribosome-CTY complex structure at 3.3Å with cryo-EM technique, where the crucial gate site A2062 ( numbering) is located at the CTY binding site within NPET. Two alternative conformations of A2062, a novel -conformation as well as a swayed conformation bound with water molecule at interface, may play a role in coordinating the binding of specific drug molecules. The previously overlooked C-H hydrogen bond (H-bond) and π interaction may collectively contribute to the enhanced binding affinity. Together, our structure data provide a structural basis for the dynamic binding as well as the specificity of CTY and explain of how a single methyl group in CTY improves its potency, which provides new evidence to reveal previously unclear mechanism of translational modulation for future drug design and anti-TB therapy. Furthermore, our sample preparation method may facilitate drug discovery based on the complexes with low water solubility drugs by cryo-EM technique. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7f0d.cif.gz 7f0d.cif.gz | 2 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7f0d.ent.gz pdb7f0d.ent.gz | 1.6 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7f0d.json.gz 7f0d.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7f0d_validation.pdf.gz 7f0d_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7f0d_full_validation.pdf.gz 7f0d_full_validation.pdf.gz | 1.8 MB | 表示 | |
| XML形式データ |  7f0d_validation.xml.gz 7f0d_validation.xml.gz | 175.3 KB | 表示 | |
| CIF形式データ |  7f0d_validation.cif.gz 7f0d_validation.cif.gz | 284.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/f0/7f0d https://data.pdbj.org/pub/pdb/validation_reports/f0/7f0d ftp://data.pdbj.org/pub/pdb/validation_reports/f0/7f0d ftp://data.pdbj.org/pub/pdb/validation_reports/f0/7f0d | HTTPS FTP |
-関連構造データ
| 関連構造データ |  31398MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
+50S ribosomal protein ... , 29種, 29分子 012346CDEFGHJKLMNOPQRSTUVWXYZ
-RNA鎖 , 2種, 2分子 AB
| #7: RNA鎖 | 分子量: 1017792.562 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  Mycobacterium tuberculosis H37Ra (結核菌) Mycobacterium tuberculosis H37Ra (結核菌)発現宿主:  |
|---|---|
| #8: RNA鎖 | 分子量: 37097.238 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  Mycobacterium tuberculosis H37Ra (結核菌) Mycobacterium tuberculosis H37Ra (結核菌)発現宿主:  |
-非ポリマー , 3種, 5分子 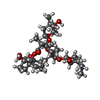




| #32: 化合物 | ChemComp-CTY / |
|---|---|
| #33: 化合物 | ChemComp-MG / |
| #34: 水 | ChemComp-HOH / |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| 由来についての詳細 | The source provided by authors are used. |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) | 生物種:  Mycobacterium tuberculosis H37Ra (結核菌) Mycobacterium tuberculosis H37Ra (結核菌) | ||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||
| 急速凍結 | 凍結剤: NITROGEN |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K2 IS (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.16_3549: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 34912 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 5V7Q Accession code: 5V7Q / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj
































