[English] 日本語
 Yorodumi
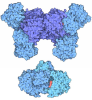
Yorodumi- PDB-7b80: DeAMPylation complex of monomeric FICD and AMPylated BiP (state 2) -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 7b80 | ||||||
|---|---|---|---|---|---|---|---|
| Title | DeAMPylation complex of monomeric FICD and AMPylated BiP (state 2) | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE / FICD / Fic / HYPE / BiP / Grp78 / AMPylation / deAMPylation / deAMPylase / ER stress / Complex / adenylation / adenylylation / Hsp70 / chaperone / transferase | ||||||
| Function / homology |  Function and homology information Function and homology informationprotein deadenylylation / protein adenylylhydrolase activity / protein adenylylation / AMPylase activity / protein adenylyltransferase / negative regulation of IRE1-mediated unfolded protein response / regulation of IRE1-mediated unfolded protein response / negative regulation of GTPase activity / Hydrolases; Acting on ester bonds; Phosphoric-diester hydrolases / post-translational protein targeting to membrane, translocation ...protein deadenylylation / protein adenylylhydrolase activity / protein adenylylation / AMPylase activity / protein adenylyltransferase / negative regulation of IRE1-mediated unfolded protein response / regulation of IRE1-mediated unfolded protein response / negative regulation of GTPase activity / Hydrolases; Acting on ester bonds; Phosphoric-diester hydrolases / post-translational protein targeting to membrane, translocation / non-chaperonin molecular chaperone ATPase / response to unfolded protein / negative regulation of protein-containing complex assembly / Hsp70 protein binding / response to endoplasmic reticulum stress / ATP-dependent protein folding chaperone / melanosome / protein-folding chaperone binding / endoplasmic reticulum lumen / endoplasmic reticulum membrane / negative regulation of apoptotic process / perinuclear region of cytoplasm / cell surface / endoplasmic reticulum / protein homodimerization activity / ATP hydrolysis activity / mitochondrion / ATP binding / identical protein binding / cytosol Similarity search - Function | ||||||
| Biological species |   Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.87 Å MOLECULAR REPLACEMENT / Resolution: 1.87 Å | ||||||
 Authors Authors | Perera, L.A. / Ron, D. | ||||||
| Funding support |  United Kingdom, 1items United Kingdom, 1items
| ||||||
 Citation Citation |  Journal: Nat Commun / Year: 2021 Journal: Nat Commun / Year: 2021Title: Structures of a deAMPylation complex rationalise the switch between antagonistic catalytic activities of FICD. Authors: Perera, L.A. / Preissler, S. / Zaccai, N.R. / Prevost, S. / Devos, J.M. / Haertlein, M. / Ron, D. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  7b80.cif.gz 7b80.cif.gz | 376.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb7b80.ent.gz pdb7b80.ent.gz | 298.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  7b80.json.gz 7b80.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/b8/7b80 https://data.pdbj.org/pub/pdb/validation_reports/b8/7b80 ftp://data.pdbj.org/pub/pdb/validation_reports/b8/7b80 ftp://data.pdbj.org/pub/pdb/validation_reports/b8/7b80 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  7b7zC  5o4pS  6i7lS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 2 molecules BA
| #1: Protein | Mass: 57543.043 Da / Num. of mol.: 1 / Mutation: T229A, V461F Source method: isolated from a genetically manipulated source Details: Covalent modification of T518 with AMP moiety / Source: (gene. exp.)   References: UniProt: G3I8R9, non-chaperonin molecular chaperone ATPase |
|---|---|
| #2: Protein | Mass: 39383.984 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Details: 2.7.7.n1 / Source: (gene. exp.)  Homo sapiens (human) / Gene: FICD, HIP13, HYPE, UNQ3041/PRO9857 / Production host: Homo sapiens (human) / Gene: FICD, HIP13, HYPE, UNQ3041/PRO9857 / Production host:  References: UniProt: Q9BVA6, Transferases; Transferring phosphorus-containing groups; Nucleotidyltransferases, Hydrolases; Acting on ester bonds; Phosphoric-diester hydrolases |
-Non-polymers , 7 types, 601 molecules 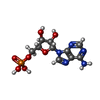












| #3: Chemical | ChemComp-AMP / | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| #4: Chemical | | #5: Chemical | ChemComp-PO4 / | #6: Chemical | #7: Chemical | #8: Chemical | #9: Water | ChemComp-HOH / | |
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.72 Å3/Da / Density % sol: 54.74 % |
|---|---|
| Crystal grow | Temperature: 298 K / Method: vapor diffusion, sitting drop / pH: 8 / Details: 0.1 M Tris pH 8.0 25% PEG 400 |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I04-1 / Wavelength: 0.9159 Å / Beamline: I04-1 / Wavelength: 0.9159 Å |
| Detector | Type: DECTRIS PILATUS 6M-F / Detector: PIXEL / Date: Jul 29, 2019 |
| Radiation | Monochromator: M / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9159 Å / Relative weight: 1 |
| Reflection | Resolution: 1.87→52.4 Å / Num. obs: 86247 / % possible obs: 100 % / Redundancy: 6.6 % / CC1/2: 0.999 / Rmerge(I) obs: 0.087 / Net I/σ(I): 11.9 |
| Reflection shell | Resolution: 1.87→1.92 Å / Redundancy: 6.9 % / Rmerge(I) obs: 1.793 / Mean I/σ(I) obs: 1 / Num. unique obs: 6270 / CC1/2: 0.536 / % possible all: 100 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 5O4P, 6I7L Resolution: 1.87→52.4 Å / Cor.coef. Fo:Fc: 0.961 / Cor.coef. Fo:Fc free: 0.953 / SU B: 8.688 / SU ML: 0.127 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.146 / ESU R Free: 0.132 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : WITH TLS ADDED
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 87.79 Å2 / Biso mean: 37.354 Å2 / Biso min: 13.82 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.87→52.4 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.87→1.919 Å / Rfactor Rfree error: 0 / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj