+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ta1 | ||||||
|---|---|---|---|---|---|---|---|
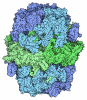
| タイトル | Fatty acid synthase of S. cerevisiae | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | BIOSYNTHETIC PROTEIN / megasynthase / complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fatty-acyl-CoA synthase system / fatty acid synthase complex / fatty-acyl-CoA synthase activity / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity / holo-[acyl-carrier-protein] synthase activity / enoyl-[acyl-carrier-protein] reductase (NADPH) activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity ...fatty-acyl-CoA synthase system / fatty acid synthase complex / fatty-acyl-CoA synthase activity / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity / holo-[acyl-carrier-protein] synthase activity / enoyl-[acyl-carrier-protein] reductase (NADPH) activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity / 3-hydroxyacyl-[acyl-carrier-protein] dehydratase / beta-ketoacyl-[acyl-carrier-protein] synthase I / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / 3-oxoacyl-[acyl-carrier-protein] reductase (NADPH) activity / 3-oxoacyl-[acyl-carrier-protein] reductase / oleoyl-[acyl-carrier-protein] hydrolase / fatty acyl-[ACP] hydrolase activity / enoyl-[acyl-carrier-protein] reductase (NADH) / enoyl-[acyl-carrier-protein] reductase (NADH) activity / long-chain fatty acid biosynthetic process / fatty acid synthase activity / 3-oxoacyl-[acyl-carrier-protein] synthase activity / lipid droplet / magnesium ion binding / mitochondrion / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||
 データ登録者 データ登録者 | Vonck, J. / D'Imprima, E. / Joppe, M. / Grininger, M. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: IUCrJ / 年: 2020 ジャーナル: IUCrJ / 年: 2020タイトル: The resolution revolution in cryoEM requires high-quality sample preparation: a rapid pipeline to a high-resolution map of yeast fatty acid synthase. 著者: Mirko Joppe / Edoardo D'Imprima / Nina Salustros / Karthik S Paithankar / Janet Vonck / Martin Grininger / Werner Kühlbrandt /  要旨: Single-particle electron cryo-microscopy (cryoEM) has undergone a 'resolution revolution' that makes it possible to characterize megadalton (MDa) complexes at atomic resolution without crystals. To ...Single-particle electron cryo-microscopy (cryoEM) has undergone a 'resolution revolution' that makes it possible to characterize megadalton (MDa) complexes at atomic resolution without crystals. To fully exploit the new opportunities in molecular microscopy, new procedures for the cloning, expression and purification of macromolecular complexes need to be explored. Macromolecular assemblies are often unstable, and invasive construct design or inadequate purification conditions and sample-preparation methods can result in disassembly or denaturation. The structure of the 2.6 MDa yeast fatty acid synthase (FAS) has been studied by electron microscopy since the 1960s. Here, a new, streamlined protocol for the rapid production of purified yeast FAS for structure determination by high-resolution cryoEM is reported. Together with a companion protocol for preparing cryoEM specimens on a hydrophilized graphene layer, the new protocol yielded a 3.1 Å resolution map of yeast FAS from 15 000 automatically picked particles within a day. The high map quality enabled a complete atomic model of an intact fungal FAS to be built. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ta1.cif.gz 6ta1.cif.gz | 3.7 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ta1.ent.gz pdb6ta1.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  6ta1.json.gz 6ta1.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6ta1_validation.pdf.gz 6ta1_validation.pdf.gz | 2.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6ta1_full_validation.pdf.gz 6ta1_full_validation.pdf.gz | 2.8 MB | 表示 | |
| XML形式データ |  6ta1_validation.xml.gz 6ta1_validation.xml.gz | 566.1 KB | 表示 | |
| CIF形式データ |  6ta1_validation.cif.gz 6ta1_validation.cif.gz | 856.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ta/6ta1 https://data.pdbj.org/pub/pdb/validation_reports/ta/6ta1 ftp://data.pdbj.org/pub/pdb/validation_reports/ta/6ta1 ftp://data.pdbj.org/pub/pdb/validation_reports/ta/6ta1 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 207264.406 Da / 分子数: 6 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: FAS2, YPL231W, P1409 / 発現宿主:  参照: UniProt: P19097, fatty-acyl-CoA synthase system, 3-oxoacyl-[acyl-carrier-protein] reductase, beta-ketoacyl-[acyl-carrier-protein] synthase I #2: タンパク質 | 分子量: 228940.375 Da / 分子数: 6 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: FAS1, YKL182W / 発現宿主:  参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, ...参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, [acyl-carrier-protein] S-malonyltransferase, oleoyl-[acyl-carrier-protein] hydrolase #3: 化合物 | ChemComp-NDP / #4: 化合物 | ChemComp-FMN / 研究の焦点であるリガンドがあるか | N | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: fatty acid synthase / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 2.6 MDa / 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 6.5 |
| 緩衝液成分 | 濃度: 100 mM / 名称: sodium phosphate |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 70 % / 凍結前の試料温度: 283 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / Cs: 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 32 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 撮影したグリッド数: 1 / 実像数: 792 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 19981 | ||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: D3 (2回x3回 2面回転対称) | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 15320 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 3HMJ Accession code: 3HMJ / Source name: PDB / タイプ: experimental model |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj