+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6shh | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human kallikrein 7 with aromatic coumarinic ester compound 1 covalently bound to H57 | ||||||
 要素 要素 | Kallikrein-7 | ||||||
 キーワード キーワード | HYDROLASE / Serine Protease / Covalent Inhibitor / Complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報stratum corneum chymotryptic enzyme / positive regulation of antibacterial peptide production / epidermal lamellar body / cornified envelope / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin / extracellular matrix disassembly / epidermis development / Degradation of the extracellular matrix / serine-type peptidase activity / secretory granule ...stratum corneum chymotryptic enzyme / positive regulation of antibacterial peptide production / epidermal lamellar body / cornified envelope / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin / extracellular matrix disassembly / epidermis development / Degradation of the extracellular matrix / serine-type peptidase activity / secretory granule / protein maturation / metalloendopeptidase activity / peptidase activity / serine-type endopeptidase activity / proteolysis / extracellular space / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Hanke, S. / Straeter, N. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2020 ジャーナル: J.Med.Chem. / 年: 2020タイトル: Structural Studies on the Inhibitory Binding Mode of Aromatic Coumarinic Esters to Human Kallikrein-Related Peptidase 7. 著者: Hanke, S. / Tindall, C.A. / Pippel, J. / Ulbricht, D. / Pirotte, B. / Reboud-Ravaux, M. / Heiker, J.T. / Strater, N. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6shh.cif.gz 6shh.cif.gz | 749.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6shh.ent.gz pdb6shh.ent.gz | 621.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6shh.json.gz 6shh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6shh_validation.pdf.gz 6shh_validation.pdf.gz | 3.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6shh_full_validation.pdf.gz 6shh_full_validation.pdf.gz | 3.5 MB | 表示 | |
| XML形式データ |  6shh_validation.xml.gz 6shh_validation.xml.gz | 80.4 KB | 表示 | |
| CIF形式データ |  6shh_validation.cif.gz 6shh_validation.cif.gz | 112.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/sh/6shh https://data.pdbj.org/pub/pdb/validation_reports/sh/6shh ftp://data.pdbj.org/pub/pdb/validation_reports/sh/6shh ftp://data.pdbj.org/pub/pdb/validation_reports/sh/6shh | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 7 | 
| ||||||||
| 8 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 8分子 ABCDEFGH
| #1: タンパク質 | 分子量: 24481.160 Da / 分子数: 8 / 由来タイプ: 組換発現 / 詳細: The inhibitor is covalently attached to H57 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: KLK7, PRSS6, SCCE / 発現宿主: Homo sapiens (ヒト) / 遺伝子: KLK7, PRSS6, SCCE / 発現宿主:  参照: UniProt: P49862, stratum corneum chymotryptic enzyme |
|---|
-非ポリマー , 5種, 1246分子 

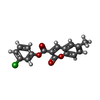






| #2: 化合物 | ChemComp-PGE / #3: 化合物 | ChemComp-SO4 / #4: 化合物 | ChemComp-SH7 / ( #5: 化合物 | #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.64 Å3/Da / 溶媒含有率: 53.37 % |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: 2.9 M ammonium sulphate, 0.1 M HEPES, pH 8.5, 0.5- 2 % PEG 3350 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  BESSY BESSY  / ビームライン: 14.1 / 波長: 0.9184 Å / ビームライン: 14.1 / 波長: 0.9184 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2018年3月28日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9184 Å / 相対比: 1 |
| 反射 | 解像度: 2→48.49 Å / Num. obs: 138723 / % possible obs: 99.2 % / 冗長度: 9.4 % / Biso Wilson estimate: 30.04 Å2 / CC1/2: 0.993 / Rmerge(I) obs: 0.33 / Rpim(I) all: 0.166 / Rrim(I) all: 0.37 / Net I/σ(I): 5.8 |
| 反射 シェル | 解像度: 2→2.04 Å / 冗長度: 8.5 % / Rmerge(I) obs: 4.121 / Mean I/σ(I) obs: 0.5 / Num. unique obs: 5745 / CC1/2: 0.229 / Rrim(I) all: 4.638 / % possible all: 84.1 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 2qxi 解像度: 2→47.03 Å / Cor.coef. Fo:Fc: 0.942 / Cor.coef. Fo:Fc free: 0.92 / SU R Cruickshank DPI: 0.17 / 交差検証法: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.181 / SU Rfree Blow DPI: 0.155 / SU Rfree Cruickshank DPI: 0.151
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 171.15 Å2 / Biso mean: 43.07 Å2 / Biso min: 18.46 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.31 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 2→47.03 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2→2.02 Å / Rfactor Rfree error: 0 / Total num. of bins used: 50
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj





