+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6s1j | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of DYRK1A with small molecule inhibitor | ||||||
 Components Components | Dual specificity tyrosine-phosphorylation-regulated kinase 1A | ||||||
 Keywords Keywords | TRANSFERASE / Kinase / catalytic domain / phosphorylated | ||||||
| Function / homology |  Function and homology information Function and homology informationregulation of amyloid-beta formation / negative regulation of heterochromatin formation / regulation of neurofibrillary tangle assembly / histone H3T45 kinase activity / dual-specificity kinase / splicing factor binding / [RNA-polymerase]-subunit kinase / tau-protein kinase activity / regulation of alternative mRNA splicing, via spliceosome / negative regulation of microtubule polymerization ...regulation of amyloid-beta formation / negative regulation of heterochromatin formation / regulation of neurofibrillary tangle assembly / histone H3T45 kinase activity / dual-specificity kinase / splicing factor binding / [RNA-polymerase]-subunit kinase / tau-protein kinase activity / regulation of alternative mRNA splicing, via spliceosome / negative regulation of microtubule polymerization / negative regulation of DNA damage response, signal transduction by p53 class mediator / negative regulation of mRNA splicing, via spliceosome / G0 and Early G1 / cytoskeletal protein binding / RNA polymerase II CTD heptapeptide repeat kinase activity / protein serine/threonine/tyrosine kinase activity / peptidyl-tyrosine phosphorylation / tubulin binding / positive regulation of RNA splicing / non-membrane spanning protein tyrosine kinase activity / circadian rhythm / tau protein binding / nervous system development / protein autophosphorylation / actin binding / protein tyrosine kinase activity / transcription coactivator activity / protein phosphorylation / protein kinase activity / nuclear speck / ribonucleoprotein complex / axon / protein serine kinase activity / protein serine/threonine kinase activity / dendrite / centrosome / positive regulation of DNA-templated transcription / nucleoplasm / ATP binding / identical protein binding / nucleus / cytoplasm / cytosol Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.408 Å molecular replacement / Resolution: 1.408 Å | ||||||
 Authors Authors | Sorrell, F.J. / Henderson, S.H. / Redondo, C. / Burgess-Brown, N.A. / von Delft, F. / Arrowsmith, C.H. / Bountra, C. / Edwards, A.M. / Elkins, J.M. | ||||||
 Citation Citation |  Journal: To be published Journal: To be publishedTitle: Kinase Scaffold Repurposing in the Public Domain Authors: Sorrell, F.J. / Henderson, S.H. / Elkins, J.M. / Ward, S. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6s1j.cif.gz 6s1j.cif.gz | 224.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6s1j.ent.gz pdb6s1j.ent.gz | 181.8 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6s1j.json.gz 6s1j.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/s1/6s1j https://data.pdbj.org/pub/pdb/validation_reports/s1/6s1j ftp://data.pdbj.org/pub/pdb/validation_reports/s1/6s1j ftp://data.pdbj.org/pub/pdb/validation_reports/s1/6s1j | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  6s11C  6s14C  6s17C  6s1bC  6s1hC  4mq1S S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Components on special symmetry positions |
|
- Components
Components
-Protein , 1 types, 1 molecules A
| #1: Protein | Mass: 42081.535 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: DYRK1A, DYRK, MNB, MNBH / Production host: Homo sapiens (human) / Gene: DYRK1A, DYRK, MNB, MNBH / Production host:  |
|---|
-Non-polymers , 5 types, 324 molecules 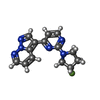








| #2: Chemical | ChemComp-KRK / | ||||||
|---|---|---|---|---|---|---|---|
| #3: Chemical | ChemComp-EDO / #4: Chemical | ChemComp-DMS / | #5: Chemical | ChemComp-SO4 / #6: Water | ChemComp-HOH / | |
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.6 Å3/Da / Density % sol: 52.65 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop Details: 2.2M ammonium sulfate -- 0.1M citrate pH 5.7 -- 0.2M sodium/potassium tartrate |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.9762 Å / Beamline: I03 / Wavelength: 0.9762 Å | ||||||||||||||||||||||||||||||
| Detector | Type: DECTRIS PILATUS 6M-F / Detector: PIXEL / Date: Jan 21, 2019 | ||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.9762 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||
| Reflection | Resolution: 1.41→59.8 Å / Num. obs: 75809 / % possible obs: 96.4 % / Redundancy: 12.2 % / Biso Wilson estimate: 12.44 Å2 / CC1/2: 0.996 / Rmerge(I) obs: 0.195 / Rpim(I) all: 0.058 / Rrim(I) all: 0.204 / Net I/σ(I): 9.5 / Num. measured all: 924128 / Scaling rejects: 508 | ||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement |
|---|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 4mq1 Resolution: 1.408→59.801 Å / SU ML: 0.15 / Cross valid method: THROUGHOUT / σ(F): 1.34 / Phase error: 18.42 / Stereochemistry target values: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 90.8 Å2 / Biso mean: 21.035 Å2 / Biso min: 6.52 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.408→59.801 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 27
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller













 PDBj
PDBj




