+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6roh | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
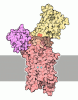
| タイトル | Cryo-EM structure of the autoinhibited Drs2p-Cdc50p | |||||||||||||||||||||
 要素 要素 |
| |||||||||||||||||||||
 キーワード キーワード | LIPID TRANSPORT / Lipid Flippase / P-type ATPase / PS Transport. | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Cdc50p-Drs2p complex / actin cortical patch localization / aminophospholipid translocation / phosphatidylcholine flippase activity / Ion transport by P-type ATPases / post-Golgi vesicle-mediated transport / phosphatidylserine flippase activity / phospholipid-translocating ATPase complex / phosphatidylserine floppase activity / ATPase-coupled intramembrane lipid transporter activity ...Cdc50p-Drs2p complex / actin cortical patch localization / aminophospholipid translocation / phosphatidylcholine flippase activity / Ion transport by P-type ATPases / post-Golgi vesicle-mediated transport / phosphatidylserine flippase activity / phospholipid-translocating ATPase complex / phosphatidylserine floppase activity / ATPase-coupled intramembrane lipid transporter activity / phosphatidylethanolamine flippase activity / endocytic recycling / P-type phospholipid transporter / phosphatidylinositol-4-phosphate binding / retrograde transport, endosome to Golgi / phospholipid translocation / Neutrophil degranulation / intracellular protein transport / trans-Golgi network / endocytosis / late endosome membrane / endosome membrane / magnesium ion binding / endoplasmic reticulum / Golgi apparatus / ATP hydrolysis activity / ATP binding / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  | |||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Timcenko, M. / Lyons, J.A. / Januliene, D. / Ulstrup, J.J. / Dieudonne, T. / Montigny, C. / Ash, M.R. / Karlsen, J.L. / Boesen, T. / Kuhlbrandt, W. ...Timcenko, M. / Lyons, J.A. / Januliene, D. / Ulstrup, J.J. / Dieudonne, T. / Montigny, C. / Ash, M.R. / Karlsen, J.L. / Boesen, T. / Kuhlbrandt, W. / Lenoir, G. / Moeller, A. / Nissen, P. | |||||||||||||||||||||
| 資金援助 |  デンマーク, デンマーク,  フランス, 6件 フランス, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2019 ジャーナル: Nature / 年: 2019タイトル: Structure and autoregulation of a P4-ATPase lipid flippase. 著者: Milena Timcenko / Joseph A Lyons / Dovile Januliene / Jakob J Ulstrup / Thibaud Dieudonné / Cédric Montigny / Miriam-Rose Ash / Jesper Lykkegaard Karlsen / Thomas Boesen / Werner ...著者: Milena Timcenko / Joseph A Lyons / Dovile Januliene / Jakob J Ulstrup / Thibaud Dieudonné / Cédric Montigny / Miriam-Rose Ash / Jesper Lykkegaard Karlsen / Thomas Boesen / Werner Kühlbrandt / Guillaume Lenoir / Arne Moeller / Poul Nissen /    要旨: Type 4 P-type ATPases (P4-ATPases) are lipid flippases that drive the active transport of phospholipids from exoplasmic or luminal leaflets to cytosolic leaflets of eukaryotic membranes. The ...Type 4 P-type ATPases (P4-ATPases) are lipid flippases that drive the active transport of phospholipids from exoplasmic or luminal leaflets to cytosolic leaflets of eukaryotic membranes. The molecular architecture of P4-ATPases and the mechanism through which they recognize and transport lipids have remained unknown. Here we describe the cryo-electron microscopy structure of the P4-ATPase Drs2p-Cdc50p, a Saccharomyces cerevisiae lipid flippase that is specific to phosphatidylserine and phosphatidylethanolamine. Drs2p-Cdc50p is autoinhibited by the C-terminal tail of Drs2p, and activated by the lipid phosphatidylinositol-4-phosphate (PtdIns4P or PI4P). We present three structures that represent the complex in an autoinhibited, an intermediate and a fully activated state. The analysis highlights specific features of P4-ATPases and reveals sites of autoinhibition and PI4P-dependent activation. We also observe a putative lipid translocation pathway in this flippase that involves a conserved PISL motif in transmembrane segment 4 and polar residues of transmembrane segments 2 and 5, in particular Lys1018, in the centre of the lipid bilayer. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6roh.cif.gz 6roh.cif.gz | 284 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6roh.ent.gz pdb6roh.ent.gz | 218.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6roh.json.gz 6roh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6roh_validation.pdf.gz 6roh_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6roh_full_validation.pdf.gz 6roh_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  6roh_validation.xml.gz 6roh_validation.xml.gz | 52.5 KB | 表示 | |
| CIF形式データ |  6roh_validation.cif.gz 6roh_validation.cif.gz | 78.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ro/6roh https://data.pdbj.org/pub/pdb/validation_reports/ro/6roh ftp://data.pdbj.org/pub/pdb/validation_reports/ro/6roh ftp://data.pdbj.org/pub/pdb/validation_reports/ro/6roh | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 2分子 AC
| #1: タンパク質 | 分子量: 163730.766 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: D560 described by Aspartate beryllium trifluoride (BFD) engineered C-terminal GGGG-LVPRGS-BAD-tag Residues 1-104 are removed by proteolysis with thrombin Residues 1364-1460 are removed after ...詳細: D560 described by Aspartate beryllium trifluoride (BFD) engineered C-terminal GGGG-LVPRGS-BAD-tag Residues 1-104 are removed by proteolysis with thrombin Residues 1364-1460 are removed after cleaving of the purification tag by thrombin 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: DRS2, YAL026C, FUN38 / プラスミド: pYedp60 / 発現宿主:  |
|---|---|
| #2: タンパク質 | 分子量: 47371.797 Da / 分子数: 1 / 由来タイプ: 組換発現 / 詳細: engineered C-terminal GGGG-LVPRGS-GG-10xHistag 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: CDC50, YCR094W, YCR94W / プラスミド: pYedp60 / 発現宿主:  |
-糖 , 3種, 3分子 
| #3: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|---|
| #4: 多糖 | beta-D-mannopyranose-(1-3)-beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4) ...beta-D-mannopyranose-(1-3)-beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
| #7: 糖 | ChemComp-NAG / |
-非ポリマー , 3種, 4分子 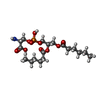




| #5: 化合物 | ChemComp-PSF / |
|---|---|
| #6: 化合物 | ChemComp-MG / |
| #8: 水 | ChemComp-HOH / |
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Binary complex of Drs2p-Cdc50p / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7 |
| 試料 | 濃度: 0.6 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: 1mM beryllium fluoride |
| 試料支持 | 詳細: 15mA / グリッドの材料: COPPER / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 278 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 8 sec. / 電子線照射量: 60 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.14_3260: / 分類: 精密化 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2157578 | ||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||
| 3次元再構成 | 解像度: 2.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 752881 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj