+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6lum | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Mycobacterium smegmatis succinate dehydrogenase 2 | ||||||||||||
 要素 要素 | (Succinate dehydrogenase subunit ...) x 5 | ||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / electron transfer chain / trimer | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / steroid dehydrogenase activity, acting on the CH-CH group of donors / succinate dehydrogenase (quinone) activity / succinate dehydrogenase / 3 iron, 4 sulfur cluster binding / steroid metabolic process / tricarboxylic acid cycle / electron transport chain / 2 iron, 2 sulfur cluster binding / flavin adenine dinucleotide binding ...: / steroid dehydrogenase activity, acting on the CH-CH group of donors / succinate dehydrogenase (quinone) activity / succinate dehydrogenase / 3 iron, 4 sulfur cluster binding / steroid metabolic process / tricarboxylic acid cycle / electron transport chain / 2 iron, 2 sulfur cluster binding / flavin adenine dinucleotide binding / 4 iron, 4 sulfur cluster binding / electron transfer activity / oxidoreductase activity / metal ion binding / membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア) | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.84 Å | ||||||||||||
 データ登録者 データ登録者 | Gao, Y. / Gong, H. / Zhou, X. / Xiao, Y. / Wang, W. / Ji, W. / Wang, Q. / Rao, Z. | ||||||||||||
| 資金援助 |  中国, 3件 中国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Cryo-EM structure of trimeric Mycobacterium smegmatis succinate dehydrogenase with a membrane-anchor SdhF. 著者: Hongri Gong / Yan Gao / Xiaoting Zhou / Yu Xiao / Weiwei Wang / Yanting Tang / Shan Zhou / Yuying Zhang / Wenxin Ji / Lu Yu / Changlin Tian / Sin Man Lam / Guanghou Shui / Luke W Guddat / ...著者: Hongri Gong / Yan Gao / Xiaoting Zhou / Yu Xiao / Weiwei Wang / Yanting Tang / Shan Zhou / Yuying Zhang / Wenxin Ji / Lu Yu / Changlin Tian / Sin Man Lam / Guanghou Shui / Luke W Guddat / Luet-Lok Wong / Quan Wang / Zihe Rao /    要旨: Diheme-containing succinate:menaquinone oxidoreductases (Sdh) are widespread in Gram-positive bacteria but little is known about the catalytic mechanisms they employ for succinate oxidation by ...Diheme-containing succinate:menaquinone oxidoreductases (Sdh) are widespread in Gram-positive bacteria but little is known about the catalytic mechanisms they employ for succinate oxidation by menaquinone. Here, we present the 2.8 Å cryo-electron microscopy structure of a Mycobacterium smegmatis Sdh, which forms a trimer. We identified the membrane-anchored SdhF as a subunit of the complex. The 3 kDa SdhF forms a single transmembrane helix and this helix plays a role in blocking the canonically proximal quinone-binding site. We also identified two distal quinone-binding sites with bound quinones. One distal binding site is formed by neighboring subunits of the complex. Our structure further reveals the electron/proton transfer pathway for succinate oxidation by menaquinone. Moreover, this study provides further structural insights into the physiological significance of a trimeric respiratory complex II. The structure of the menaquinone binding site could provide a framework for the development of Sdh-selective anti-mycobacterial drugs. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6lum.cif.gz 6lum.cif.gz | 597.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6lum.ent.gz pdb6lum.ent.gz | 480.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6lum.json.gz 6lum.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6lum_validation.pdf.gz 6lum_validation.pdf.gz | 2.8 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6lum_full_validation.pdf.gz 6lum_full_validation.pdf.gz | 2.9 MB | 表示 | |
| XML形式データ |  6lum_validation.xml.gz 6lum_validation.xml.gz | 119.1 KB | 表示 | |
| CIF形式データ |  6lum_validation.cif.gz 6lum_validation.cif.gz | 162.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/lu/6lum https://data.pdbj.org/pub/pdb/validation_reports/lu/6lum ftp://data.pdbj.org/pub/pdb/validation_reports/lu/6lum ftp://data.pdbj.org/pub/pdb/validation_reports/lu/6lum | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Succinate dehydrogenase subunit ... , 5種, 15分子 CGMDHNEIOAJPBKQ
| #1: タンパク質 | 分子量: 15644.627 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: MC2 51 / 参照: UniProt: A0QT10*PLUS #2: タンパク質 | 分子量: 19280.400 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: MC2 51 / 参照: UniProt: A0QT09*PLUS #3: タンパク質・ペプチド | 分子量: 3707.443 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: MC2 51 / 参照: UniProt: A0R4D1*PLUS #4: タンパク質 | 分子量: 64476.754 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: MC2 51 / 参照: UniProt: A0QT08*PLUS #5: タンパク質 | 分子量: 29245.760 Da / 分子数: 3 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: MC2 51 / 参照: UniProt: A0QT07*PLUS |
|---|
-非ポリマー , 10種, 39分子 

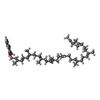
















| #6: 化合物 | ChemComp-PEV / ( #7: 化合物 | ChemComp-HEM / #8: 化合物 | ChemComp-MQ9 / #9: 化合物 | #10: 化合物 | #11: 化合物 | #12: 化合物 | #13: 化合物 | #14: 化合物 | #15: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Mycobaterium smegmatis Succinate dehydrogenase 2 / タイプ: COMPLEX / Entity ID: #1-#5 / 由来: NATURAL | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.4 MDa / 実験値: YES | ||||||||||||||||||||
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア)株: mc2 51 | ||||||||||||||||||||
| 緩衝液 | pH: 7.4 / 詳細: Solutions were made fresh | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: This sample was mono disperse. | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK II / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 281 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: BRIGHT FIELD / Cs: 2.7 mm / C2レンズ絞り径: 70 µm |
| 撮影 | 平均露光時間: 2 sec. / 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.16_3549: / 分類: 精密化 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.84 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 461385 / アルゴリズム: FOURIER SPACE / 詳細: cryoSPARC software was used for the reconstruction. / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||
| 精密化 | 最高解像度: 2.84 Å | ||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj






















