+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6k32 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | RdRp complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | VIRAL PROTEIN/RNA / Cypovirus / Transcription / RNA-dependent RNA polymerase / VIRAL PROTEIN-RNA complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報T=2 icosahedral viral capsid / viral inner capsid / viral genome replication / RNA-dependent RNA polymerase activity / RNA binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||
 データ登録者 データ登録者 | Li, X.W. | ||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2020 ジャーナル: J Mol Biol / 年: 2020タイトル: Structure of RdRps Within a Transcribing dsRNA Virus Provides Insights Into the Mechanisms of RNA Synthesis. 著者: Xiaowu Li / Li Wang / Xurong Wang / Wenyuan Chen / Tao Yang / Jingdong Song / Hongrong Liu / Lingpeng Cheng /  要旨: RNA-dependent RNA polymerases (RdRps) catalyze RNA synthesis of RNA viruses. During initiation of RNA synthesis, the RdRp catalyzes the formation of the first dinucleotide, acting as primer for ...RNA-dependent RNA polymerases (RdRps) catalyze RNA synthesis of RNA viruses. During initiation of RNA synthesis, the RdRp catalyzes the formation of the first dinucleotide, acting as primer for subsequent processive RNA elongation. Here, we present the structure of the RdRp complexes in the dinucleotide primed state in situ within a transcribing cypovirus under near physiological conditions using cryo-electron microscopy. The 3' end of RNA templates, paired RNA dinucleotide primer, incoming nucleotide, and catalytic divalent cations in the RdRp were resolved at 3.8 Å resolution. The end of the RNA template and the dinucleotide is buttressed by the aromatic tyrosine in a loop from the RdRp bracelet domain. Our structure reveals the interactions between the nucleotide substrates and the conserved residues during the RdRp initiation, and the coordinated structural changes preceding the elongation stage. In addition, it provides the direct evidence for existence of the slow step of the dinucleotide primed state in the viral RdRp transcription. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6k32.cif.gz 6k32.cif.gz | 1.3 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6k32.ent.gz pdb6k32.ent.gz | 1.1 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6k32.json.gz 6k32.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6k32_validation.pdf.gz 6k32_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6k32_full_validation.pdf.gz 6k32_full_validation.pdf.gz | 1.6 MB | 表示 | |
| XML形式データ |  6k32_validation.xml.gz 6k32_validation.xml.gz | 197.9 KB | 表示 | |
| CIF形式データ |  6k32_validation.cif.gz 6k32_validation.cif.gz | 306 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/k3/6k32 https://data.pdbj.org/pub/pdb/validation_reports/k3/6k32 ftp://data.pdbj.org/pub/pdb/validation_reports/k3/6k32 ftp://data.pdbj.org/pub/pdb/validation_reports/k3/6k32 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 5種, 7分子 ABCDEFG
| #1: タンパク質 | 分子量: 137058.922 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料)参照: UniProt: D0EZK6 | ||
|---|---|---|---|
| #2: タンパク質 | 分子量: 63379.449 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) / 遺伝子: VP4 Cypovirus 1 (サポウイルス 1) / 遺伝子: VP4発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料)参照: UniProt: C7EWL9 | ||
| #5: タンパク質 | 分子量: 136769.422 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料)参照: UniProt: D3JWE6, UniProt: Q6TS43*PLUS | ||
| #6: タンパク質 | 分子量: 135002.609 Da / 分子数: 3 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料)参照: UniProt: D3JWE6, UniProt: Q6TS43*PLUS #7: タンパク質 | | 分子量: 137422.234 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料)参照: UniProt: D3JWE6, UniProt: Q6TS43*PLUS |
-RNA鎖 , 2種, 2分子 tp
| #3: RNA鎖 | 分子量: 1507.928 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料) |
|---|---|
| #4: RNA鎖 | 分子量: 869.394 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Cypovirus 1 (サポウイルス 1) Cypovirus 1 (サポウイルス 1)発現宿主:  invertebrate environmental sample (環境試料) invertebrate environmental sample (環境試料) |
-非ポリマー , 5種, 6分子 
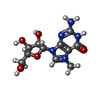
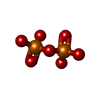
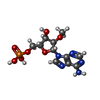
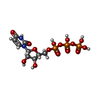




| #8: 化合物 | | #9: 化合物 | ChemComp-MG7 / | #10: 化合物 | ChemComp-DPO / | #11: 化合物 | ChemComp-A2M / | #12: 化合物 | ChemComp-UTP / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Cypovirus / タイプ: VIRUS / Entity ID: #1-#7 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  Cypovirus (ウイルス) Cypovirus (ウイルス) |
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: OTHER / タイプ: VIRION |
| 緩衝液 | pH: 8 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: OTHER |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI ARCTICA |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 20 e/Å2 フィルム・検出器のモデル: FEI FALCON II (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.13_2998: / 分類: 精密化 |
|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION |
| 3次元再構成 | 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 100000 / 対称性のタイプ: POINT |
| 精密化 | 最高解像度: 3.2 Å |
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj





