+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6jrr | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of RyR2 (*F/A/C/L-Ca2+ dataset) | ||||||
 Components Components |
| ||||||
 Keywords Keywords | MEMBRANE PROTEIN/ISOMERASE / cryo-EM / MEMBRANE PROTEIN / MEMBRANE PROTEIN-ISOMERASE complex | ||||||
| Function / homology |  Function and homology information Function and homology information: / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / response to redox state / negative regulation of heart rate / 'de novo' protein folding / FK506 binding ...: / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / response to redox state / negative regulation of heart rate / 'de novo' protein folding / FK506 binding / smooth muscle contraction / T cell proliferation / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / calcium channel inhibitor activity / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / Ion homeostasis / release of sequestered calcium ion into cytosol / calcium channel complex / sarcoplasmic reticulum membrane / protein maturation / peptidylprolyl isomerase / calcium channel regulator activity / peptidyl-prolyl cis-trans isomerase activity / calcium-mediated signaling / Stimuli-sensing channels / Z disc / positive regulation of cytosolic calcium ion concentration / protein refolding / transmembrane transporter binding / signaling receptor binding / membrane / cytoplasm Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.9 Å | ||||||
 Authors Authors | Gong, D.S. / Chi, X.M. / Zhou, G.W. / Huang, G.X.Y. / Lei, J.L. / Yan, N. | ||||||
 Citation Citation |  Journal: Nature / Year: 2019 Journal: Nature / Year: 2019Title: Modulation of cardiac ryanodine receptor 2 by calmodulin. Authors: Deshun Gong / Ximin Chi / Jinhong Wei / Gewei Zhou / Gaoxingyu Huang / Lin Zhang / Ruiwu Wang / Jianlin Lei / S R Wayne Chen / Nieng Yan /    Abstract: The high-conductance intracellular calcium (Ca) channel RyR2 is essential for the coupling of excitation and contraction in cardiac muscle. Among various modulators, calmodulin (CaM) regulates RyR2 ...The high-conductance intracellular calcium (Ca) channel RyR2 is essential for the coupling of excitation and contraction in cardiac muscle. Among various modulators, calmodulin (CaM) regulates RyR2 in a Ca-dependent manner. Here we reveal the regulatory mechanism by which porcine RyR2 is modulated by human CaM through the structural determination of RyR2 under eight conditions. Apo-CaM and Ca-CaM bind to distinct but overlapping sites in an elongated cleft formed by the handle, helical and central domains. The shift in CaM-binding sites on RyR2 is controlled by Ca binding to CaM, rather than to RyR2. Ca-CaM induces rotations and intradomain shifts of individual central domains, resulting in pore closure of the PCB95 and Ca-activated channel. By contrast, the pore of the ATP, caffeine and Ca-activated channel remains open in the presence of Ca-CaM, which suggests that Ca-CaM is one of the many competing modulators of RyR2 gating. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6jrr.cif.gz 6jrr.cif.gz | 2.4 MB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6jrr.ent.gz pdb6jrr.ent.gz | Display |  PDB format PDB format | |
| PDBx/mmJSON format |  6jrr.json.gz 6jrr.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/jr/6jrr https://data.pdbj.org/pub/pdb/validation_reports/jr/6jrr ftp://data.pdbj.org/pub/pdb/validation_reports/jr/6jrr ftp://data.pdbj.org/pub/pdb/validation_reports/jr/6jrr | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  9879MC  9831C  9833C  9834C  9836C  9837C  9880C  9889C  6ji0C  6ji8C  6jiiC  6jiuC  6jiyC  6jrsC  6jv2C M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
-Protein , 2 types, 8 molecules ACEGBDFH
| #1: Protein | Mass: 564905.625 Da / Num. of mol.: 4 / Source method: isolated from a natural source / Source: (natural)  #2: Protein | Mass: 11798.501 Da / Num. of mol.: 4 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / Production host: Homo sapiens (human) / Gene: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / Production host:  |
|---|
-Non-polymers , 4 types, 16 molecules 


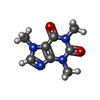



| #3: Chemical | ChemComp-ZN / #4: Chemical | ChemComp-CA / #5: Chemical | ChemComp-ATP / #6: Chemical | ChemComp-CFF / |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: RyR2 in complex with FKBP12.6 / Type: COMPLEX / Entity ID: #1-#2 / Source: NATURAL |
|---|---|
| Source (natural) | Organism:  |
| Buffer solution | pH: 7.4 |
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD |
| Image recording | Electron dose: 50 e/Å2 / Film or detector model: GATAN K2 SUMMIT (4k x 4k) |
- Processing
Processing
| EM software |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||
| Symmetry | Point symmetry: C4 (4 fold cyclic) | ||||||||||||||||
| 3D reconstruction | Resolution: 3.9 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 149212 / Symmetry type: POINT |
 Movie
Movie Controller
Controller











 PDBj
PDBj








