+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6gb0 | ||||||
|---|---|---|---|---|---|---|---|
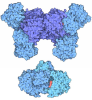
| タイトル | The Structure of variant K294A of the Mo-insertase domain Cnx1E from Arabidopsis thaliana in complex with AMP | ||||||
 要素 要素 | Molybdopterin biosynthesis protein CNX1 | ||||||
 キーワード キーワード | TRANSFERASE / Arabidopsis / Arabidopsis Proteins / Coenzymes / Metalloproteins / Catalytic Domain / Nucleotide Binding / Entropic Enzyme / Adenosine Monophosphate | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報molybdopterin adenylyltransferase / molybdopterin adenylyltransferase activity / molybdopterin molybdotransferase / nitrate reductase activity / molybdopterin molybdotransferase activity / auxin-activated signaling pathway / molybdenum ion binding / Mo-molybdopterin cofactor biosynthetic process / response to metal ion / ATP binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.814 Å 分子置換 / 解像度: 1.814 Å | ||||||
 データ登録者 データ登録者 | Krausze, J. | ||||||
 引用 引用 |  ジャーナル: Biochem. J. / 年: 2018 ジャーナル: Biochem. J. / 年: 2018タイトル: The functional principle of eukaryotic molybdenum insertases. 著者: Krausze, J. / Hercher, T.W. / Zwerschke, D. / Kirk, M.L. / Blankenfeldt, W. / Mendel, R.R. / Kruse, T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6gb0.cif.gz 6gb0.cif.gz | 324.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6gb0.ent.gz pdb6gb0.ent.gz | 265 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6gb0.json.gz 6gb0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6gb0_validation.pdf.gz 6gb0_validation.pdf.gz | 755 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6gb0_full_validation.pdf.gz 6gb0_full_validation.pdf.gz | 756.1 KB | 表示 | |
| XML形式データ |  6gb0_validation.xml.gz 6gb0_validation.xml.gz | 19 KB | 表示 | |
| CIF形式データ |  6gb0_validation.cif.gz 6gb0_validation.cif.gz | 28.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/gb/6gb0 https://data.pdbj.org/pub/pdb/validation_reports/gb/6gb0 ftp://data.pdbj.org/pub/pdb/validation_reports/gb/6gb0 ftp://data.pdbj.org/pub/pdb/validation_reports/gb/6gb0 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6etdC  6etfC  6ethC  6gaxC  6gb4C  6gb9C  6gbcC  6gbfC  5g2rS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| その他のデータベース |
|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 49720.992 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: CNX1, At5g20990, F22D1.6, T10F18.20 / プラスミド: pGplus-Cnx1E / 詳細 (発現宿主): PQ80 DERIVATIVE / 発現宿主:  参照: UniProt: Q39054, molybdopterin molybdotransferase, molybdopterin adenylyltransferase |
|---|
-非ポリマー , 5種, 270分子 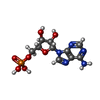








| #2: 化合物 | ChemComp-AMP / | ||
|---|---|---|---|
| #3: 化合物 | ChemComp-MG / | ||
| #4: 化合物 | ChemComp-EDO / | ||
| #5: 化合物 | | #6: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.64 Å3/Da / 溶媒含有率: 53.52 % / 解説: isometric tetragonal prism |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 6.5 詳細: 0.1 M imidazole, 0.1 M MES pH 6.5; 0.06 M sodium nitrate, 0.06 M sodium phosphate, 0.06 M ammonium sulfate; 20 % (v/v) PEG 500 MME, 10 % PEG 8000 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  BESSY BESSY  / ビームライン: 14.1 / 波長: 0.9184 Å / ビームライン: 14.1 / 波長: 0.9184 Å |
| 検出器 | タイプ: DECTRIS PILATUS3 6M / 検出器: PIXEL / 日付: 2017年6月3日 / 詳細: mirrors |
| 放射 | モノクロメーター: SI111 double crystal with sagital bender プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9184 Å / 相対比: 1 |
| 反射 | 解像度: 1.814→42.791 Å / Num. obs: 32849 / % possible obs: 66.3 % / Observed criterion σ(F): -3 / 冗長度: 4.4 % / Biso Wilson estimate: 30.34 Å2 / CC1/2: 0.995 / Rmerge(I) obs: 0.089 / Rpim(I) all: 0.072 / Rrim(I) all: 0.115 / Net I/σ(I): 8.3 |
| 反射 シェル | 解像度: 1.814→2.089 Å / 冗長度: 4.7 % / Rmerge(I) obs: 0.665 / Num. unique obs: 2737 / CC1/2: 0.732 / Rpim(I) all: 0.532 / Rrim(I) all: 0.854 / % possible all: 16.2 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 5G2R 解像度: 1.814→24.06 Å / Cor.coef. Fo:Fc: 0.947 / Cor.coef. Fo:Fc free: 0.928 / SU R Cruickshank DPI: 0.285 / 交差検証法: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.17 / SU Rfree Blow DPI: 0.145 / SU Rfree Cruickshank DPI: 0.144 詳細: Data were corrected for anisotropy prior to refinement
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 34.77 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.27 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 解像度: 1.814→24.06 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.814→1.87 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Origin x: 27.5681 Å / Origin y: 19.5594 Å / Origin z: 1.2906 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ | Selection details: { A|* } |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj