| 登録情報 | データベース: PDB / ID: 6ddi
|
|---|
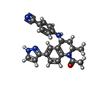
| タイトル | Crystal Structure of the human BRD2 BD1 bromodomain in complex with a Tetrahydroquinoline analogue |
|---|
 要素 要素 | Bromodomain-containing protein 2 |
|---|
 キーワード キーワード | Transcription/Inhibitor / BET / BRD2 / bromodomain / Inhibitor / Complex / Transcription / Transcription-Inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
acetylation-dependent protein binding / chromatin looping / RUNX3 regulates p14-ARF / positive regulation of T-helper 17 cell lineage commitment / protein localization to chromatin / histone reader activity / : / neural tube closure / nucleosome assembly / spermatogenesis ...acetylation-dependent protein binding / chromatin looping / RUNX3 regulates p14-ARF / positive regulation of T-helper 17 cell lineage commitment / protein localization to chromatin / histone reader activity / : / neural tube closure / nucleosome assembly / spermatogenesis / histone binding / nuclear speck / chromatin remodeling / protein serine/threonine kinase activity / chromatin binding / regulation of transcription by RNA polymerase II / chromatin / nucleoplasm / nucleus / cytoplasm類似検索 - 分子機能 Brdt, bromodomain, repeat I / Brdt, bromodomain, repeat II / NET domain superfamily / NET domain profile. / : / NET domain / Bromodomain extra-terminal - transcription regulation / Bromodomain-like / Histone Acetyltransferase; Chain A / Bromodomain, conserved site ...Brdt, bromodomain, repeat I / Brdt, bromodomain, repeat II / NET domain superfamily / NET domain profile. / : / NET domain / Bromodomain extra-terminal - transcription regulation / Bromodomain-like / Histone Acetyltransferase; Chain A / Bromodomain, conserved site / Bromodomain signature. / Bromodomain / Bromodomain (BrD) profile. / bromo domain / Bromodomain / Bromodomain-like superfamily / Up-down Bundle / Mainly Alpha類似検索 - ドメイン・相同性 methanesulfonic acid / Chem-G7V / Bromodomain-containing protein 2類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.5 Å 分子置換 / 解像度: 1.5 Å |
|---|
 データ登録者 データ登録者 | White, S.W. / Yun, M. |
|---|
 引用 引用 |  ジャーナル: Cancer Res. / 年: 2020 ジャーナル: Cancer Res. / 年: 2020
タイトル: Bromodomain-Selective BET Inhibitors Are Potent Antitumor Agents against MYC-Driven Pediatric Cancer.
著者: Slavish, P.J. / Chi, L. / Yun, M.K. / Tsurkan, L. / Martinez, N.E. / Jonchere, B. / Chai, S.C. / Connelly, M. / Waddell, M.B. / Das, S. / Neale, G. / Li, Z. / Shadrick, W.R. / Olsen, R.R. / ...著者: Slavish, P.J. / Chi, L. / Yun, M.K. / Tsurkan, L. / Martinez, N.E. / Jonchere, B. / Chai, S.C. / Connelly, M. / Waddell, M.B. / Das, S. / Neale, G. / Li, Z. / Shadrick, W.R. / Olsen, R.R. / Freeman, K.W. / Low, J.A. / Price, J.E. / Young, B.M. / Bharatham, N. / Boyd, V.A. / Yang, J. / Lee, R.E. / Morfouace, M. / Roussel, M.F. / Chen, T. / Savic, D. / Guy, R.K. / White, S.W. / Shelat, A.A. / Potter, P.M. |
|---|
| 履歴 | | 登録 | 2018年5月10日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年11月13日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年11月25日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2023年10月11日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.5 Å
分子置換 / 解像度: 1.5 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Cancer Res. / 年: 2020
ジャーナル: Cancer Res. / 年: 2020 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6ddi.cif.gz
6ddi.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6ddi.ent.gz
pdb6ddi.ent.gz PDB形式
PDB形式 6ddi.json.gz
6ddi.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/dd/6ddi
https://data.pdbj.org/pub/pdb/validation_reports/dd/6ddi ftp://data.pdbj.org/pub/pdb/validation_reports/dd/6ddi
ftp://data.pdbj.org/pub/pdb/validation_reports/dd/6ddi リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 遺伝子: BRD2, KIAA9001, RING3 / プラスミド: pET28a(+) / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: BRD2, KIAA9001, RING3 / プラスミド: pET28a(+) / 発現宿主: 







 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-BM / 波長: 1 Å
/ ビームライン: 22-BM / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj




