| 登録情報 | データベース: PDB / ID: 6cdr
|
|---|
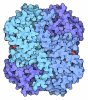
| タイトル | Human CtBP1 (28-378) |
|---|
 要素 要素 | C-terminal-binding protein 1 |
|---|
 キーワード キーワード | TRANSCRIPTION / CtBP / NADH / Cancer target |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
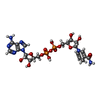
Signaling by TCF7L2 mutants / Repression of WNT target genes / synaptic vesicle clustering / presynaptic active zone cytoplasmic component / 酸化還元酵素; CH-OHの結合に対し酸化酵素として働く; NAD又はNADPを用いる / oxidoreductase activity, acting on the CH-OH group of donors, NAD or NADP as acceptor / lncRNA binding / white fat cell differentiation / synaptic vesicle endocytosis / Notch signaling pathway ...Signaling by TCF7L2 mutants / Repression of WNT target genes / synaptic vesicle clustering / presynaptic active zone cytoplasmic component / 酸化還元酵素; CH-OHの結合に対し酸化酵素として働く; NAD又はNADPを用いる / oxidoreductase activity, acting on the CH-OH group of donors, NAD or NADP as acceptor / lncRNA binding / white fat cell differentiation / synaptic vesicle endocytosis / Notch signaling pathway / transcription repressor complex / SUMOylation of transcription cofactors / viral genome replication / transcription corepressor binding / transcription coregulator binding / Deactivation of the beta-catenin transactivating complex / GABA-ergic synapse / NAD binding / transcription corepressor activity / DNA-binding transcription factor binding / RNA polymerase II-specific DNA-binding transcription factor binding / transcription coactivator activity / protein phosphorylation / regulation of cell cycle / protein domain specific binding / negative regulation of cell population proliferation / negative regulation of DNA-templated transcription / chromatin binding / regulation of transcription by RNA polymerase II / glutamatergic synapse / negative regulation of transcription by RNA polymerase II / nucleoplasm / identical protein binding / nucleus類似検索 - 分子機能 C-terminal binding protein / : / D-isomer specific 2-hydroxyacid dehydrogenases NAD-binding signature. / D-isomer specific 2-hydroxyacid dehydrogenases signature 3. / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site 1 / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD binding domain ...C-terminal binding protein / : / D-isomer specific 2-hydroxyacid dehydrogenases NAD-binding signature. / D-isomer specific 2-hydroxyacid dehydrogenases signature 3. / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain conserved site 1 / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, catalytic domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD-binding domain / D-isomer specific 2-hydroxyacid dehydrogenase, NAD binding domain / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 FORMIC ACID / 1,4-DIHYDRONICOTINAMIDE ADENINE DINUCLEOTIDE / C-terminal-binding protein 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.399 Å 分子置換 / 解像度: 2.399 Å |
|---|
 データ登録者 データ登録者 | Royer, W.E. / Bellesis, A.G. |
|---|
| 資金援助 |  米国, 2件 米国, 2件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | R01 GM119014 |  米国 米国 | | National Institutes of Health/Office of the Director | S10 OD012028 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: J. Biol. Chem. / 年: 2018 ジャーナル: J. Biol. Chem. / 年: 2018
タイトル: Assembly of human C-terminal binding protein (CtBP) into tetramers.
著者: Bellesis, A.G. / Jecrois, A.M. / Hayes, J.A. / Schiffer, C.A. / Royer, W.E. |
|---|
| 履歴 | | 登録 | 2018年2月9日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2018年5月9日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年6月20日 | Group: Data collection / Database references / カテゴリ: citation / citation_author
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title / _citation_author.name |
|---|
| 改定 1.2 | 2019年2月20日 | Group: Author supporting evidence / Data collection / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.3 | 2020年1月1日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.4 | 2023年10月4日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 2.399 Å
分子置換 / 解像度: 2.399 Å  データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: J. Biol. Chem. / 年: 2018
ジャーナル: J. Biol. Chem. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6cdr.cif.gz
6cdr.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6cdr.ent.gz
pdb6cdr.ent.gz PDB形式
PDB形式 6cdr.json.gz
6cdr.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/cd/6cdr
https://data.pdbj.org/pub/pdb/validation_reports/cd/6cdr ftp://data.pdbj.org/pub/pdb/validation_reports/cd/6cdr
ftp://data.pdbj.org/pub/pdb/validation_reports/cd/6cdr リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 遺伝子: CTBP1, CTBP / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: CTBP1, CTBP / 発現宿主: 






 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54178 Å
回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54178 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj