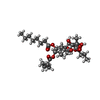
| 登録情報 | データベース: PDB / ID: 5zmv
|
|---|
| タイトル | Crystal structure of the E309A mutant of SR Ca2+-ATPase in E2(TG) |
|---|
 要素 要素 | Sarcoplasmic/endoplasmic reticulum calcium ATPase 1 |
|---|
 キーワード キーワード | HYDROLASE / MEMBRANE PROTEIN / P-TYPE ATPASE / HAD FOLD / ATP-BINDING / CALCIUM TRANSPORT / ENDOPLASMIC RETICULUM / ION TRANSPORT / MAGNESIUM / METAL-BINDING / NUCLEOTIDE-BINDING / PHOSPHORYLATION / SARCOPLASMIC RETICULUM / TRANSMEMBRANE / TRANSPORT |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of cardiac muscle cell contraction / positive regulation of calcium ion import into sarcoplasmic reticulum / positive regulation of ATPase-coupled calcium transmembrane transporter activity / positive regulation of fast-twitch skeletal muscle fiber contraction / H zone / regulation of striated muscle contraction / calcium ion import into sarcoplasmic reticulum / negative regulation of striated muscle contraction / P-type Ca2+ transporter / P-type calcium transporter activity ...positive regulation of cardiac muscle cell contraction / positive regulation of calcium ion import into sarcoplasmic reticulum / positive regulation of ATPase-coupled calcium transmembrane transporter activity / positive regulation of fast-twitch skeletal muscle fiber contraction / H zone / regulation of striated muscle contraction / calcium ion import into sarcoplasmic reticulum / negative regulation of striated muscle contraction / P-type Ca2+ transporter / P-type calcium transporter activity / I band / endoplasmic reticulum-Golgi intermediate compartment / sarcoplasmic reticulum membrane / sarcoplasmic reticulum / calcium ion transport / calcium ion binding / endoplasmic reticulum membrane / perinuclear region of cytoplasm / endoplasmic reticulum / ATP hydrolysis activity / ATP binding / membrane類似検索 - 分子機能 Calcium-transporting ATPase, transmembrane domain / Calcium-transporting ATPase, transmembrane domain / P-type ATPase, subfamily IIA, SERCA-type / Calcium-transporting ATPase, cytoplasmic transduction domain A / Calcium-transporting ATPase, cytoplasmic transduction domain A / haloacid dehalogenase-like hydrolase / Calcium-transporting ATPase, cytoplasmic domain N / Calcium-transporting ATPase, cytoplasmic domain N / Cation-transporting P-type ATPase, C-terminal / Cation transporting ATPase, C-terminus ...Calcium-transporting ATPase, transmembrane domain / Calcium-transporting ATPase, transmembrane domain / P-type ATPase, subfamily IIA, SERCA-type / Calcium-transporting ATPase, cytoplasmic transduction domain A / Calcium-transporting ATPase, cytoplasmic transduction domain A / haloacid dehalogenase-like hydrolase / Calcium-transporting ATPase, cytoplasmic domain N / Calcium-transporting ATPase, cytoplasmic domain N / Cation-transporting P-type ATPase, C-terminal / Cation transporting ATPase, C-terminus / Cation transporter/ATPase, N-terminus / Cation-transporting P-type ATPase, N-terminal / Cation transporter/ATPase, N-terminus / Cation transport ATPase (P-type) / E1-E2 ATPase / HAD superfamily/HAD-like / P-type ATPase, haloacid dehalogenase domain / P-type ATPase, phosphorylation site / P-type ATPase, cytoplasmic domain N / E1-E2 ATPases phosphorylation site. / P-type ATPase, A domain superfamily / P-type ATPase / P-type ATPase, transmembrane domain superfamily / haloacid dehalogenase-like hydrolase / HAD superfamily / HAD-like superfamily / Distorted Sandwich / Up-down Bundle / Rossmann fold / 3-Layer(aba) Sandwich / Mainly Beta / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 PHOSPHATIDYLETHANOLAMINE / Chem-TG1 / Sarcoplasmic/endoplasmic reticulum calcium ATPase 1類似検索 - 構成要素 |
|---|
| 生物種 |   Oryctolagus cuniculus (ウサギ) Oryctolagus cuniculus (ウサギ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.3 Å 分子置換 / 解像度: 3.3 Å |
|---|
 データ登録者 データ登録者 | Ogawa, H. / Hirata, A. / Tsueda, J. / Toyoshima, C. |
|---|
| 資金援助 |  日本, 1件 日本, 1件 | 組織 | 認可番号 | 国 |
|---|
| |  日本 日本 |
|
|---|
 引用 引用 |  ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018 ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018
タイトル: Mechanism of the E2 to E1 transition in Ca2+pump revealed by crystal structures of gating residue mutants.
著者: Tsunekawa, N. / Ogawa, H. / Tsueda, J. / Akiba, T. / Toyoshima, C. |
|---|
| 履歴 | | 登録 | 2018年4月6日 | 登録サイト: PDBJ / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2018年12月12日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年12月26日 | Group: Data collection / Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.2 | 2024年11月13日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / entity / pdbx_entity_nonpoly / pdbx_entry_details / pdbx_modification_feature
Item: _chem_comp.name / _database_2.pdbx_DOI ..._chem_comp.name / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3.3 Å
分子置換 / 解像度: 3.3 Å  データ登録者
データ登録者 日本, 1件
日本, 1件  引用
引用 ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018
ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5zmv.cif.gz
5zmv.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5zmv.ent.gz
pdb5zmv.ent.gz PDB形式
PDB形式 5zmv.json.gz
5zmv.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5zmv_validation.pdf.gz
5zmv_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5zmv_full_validation.pdf.gz
5zmv_full_validation.pdf.gz 5zmv_validation.xml.gz
5zmv_validation.xml.gz 5zmv_validation.cif.gz
5zmv_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/zm/5zmv
https://data.pdbj.org/pub/pdb/validation_reports/zm/5zmv ftp://data.pdbj.org/pub/pdb/validation_reports/zm/5zmv
ftp://data.pdbj.org/pub/pdb/validation_reports/zm/5zmv リンク
リンク 集合体
集合体
 要素
要素
 Chlorocebus sabaeus (オナガザル) / 参照: UniProt: P04191, EC: 3.6.3.8
Chlorocebus sabaeus (オナガザル) / 参照: UniProt: P04191, EC: 3.6.3.8 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SPring-8
SPring-8  / ビームライン: BL41XU / 波長: 0.9 Å
/ ビームライン: BL41XU / 波長: 0.9 Å 解析
解析 分子置換 / 解像度: 3.3→15.976 Å / SU ML: 0.37 / 交差検証法: FREE R-VALUE / σ(F): 1.4 / 位相誤差: 21.57
分子置換 / 解像度: 3.3→15.976 Å / SU ML: 0.37 / 交差検証法: FREE R-VALUE / σ(F): 1.4 / 位相誤差: 21.57  ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj