Entry Database : PDB / ID : 5xn3Title Crystal structure of SPSB2 in complex with a rational designed RGD containing cyclic peptide inhibitor of SPSB2-iNOS interaction SPRY domain-containing SOCS box protein 2 cR8 peptide from NOS2 Keywords / / / / / / / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / Biological species Homo sapiens (human)Method / / / Resolution : 1.34 Å Authors You, T. / Kuang, Z. Funding support Organization Grant number Country National Natural Science Foundation of China 31270817 National Natural Science Foundation of China 81571539
Journal : Biochem. Biophys. Res. Commun. / Year : 2017Title : Crystal structure of SPSB2 in complex with a rational designed RGD-containing cyclic peptide inhibitor of SPSB2-iNOS interaction.Authors : You, T. / Wang, Y. / Li, K. / Zhang, D. / Wei, H. / Luo, Y. / Li, H. / Lu, Y. / Su, X. / Kuang, Z. History Deposition May 17, 2017 Deposition site / Processing site Revision 1.0 Jun 14, 2017 Provider / Type Revision 1.1 Jul 5, 2017 Group / Category Item _citation.country / _citation.journal_id_ASTM ... _citation.country / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title Revision 1.2 Nov 22, 2023 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_conn Item / _database_2.pdbx_database_accession / _struct_conn.pdbx_leaving_atom_flagRevision 1.3 Nov 13, 2024 Group / Category / pdbx_modification_feature / Item
Show all Show less
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information Homo sapiens (human)
Homo sapiens (human) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.34 Å
MOLECULAR REPLACEMENT / Resolution: 1.34 Å  Authors
Authors China, 2items
China, 2items  Citation
Citation Journal: Biochem. Biophys. Res. Commun. / Year: 2017
Journal: Biochem. Biophys. Res. Commun. / Year: 2017 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 5xn3.cif.gz
5xn3.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb5xn3.ent.gz
pdb5xn3.ent.gz PDB format
PDB format 5xn3.json.gz
5xn3.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/xn/5xn3
https://data.pdbj.org/pub/pdb/validation_reports/xn/5xn3 ftp://data.pdbj.org/pub/pdb/validation_reports/xn/5xn3
ftp://data.pdbj.org/pub/pdb/validation_reports/xn/5xn3
 Links
Links Assembly
Assembly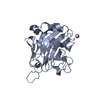
 Components
Components Homo sapiens (human) / Gene: SPSB2, GRCC9, SSB2 / Production host:
Homo sapiens (human) / Gene: SPSB2, GRCC9, SSB2 / Production host: 
 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  SSRF
SSRF  / Beamline: BL19U1 / Wavelength: 0.9778 Å
/ Beamline: BL19U1 / Wavelength: 0.9778 Å Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller











 PDBj
PDBj





