+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5hvp | ||||||
|---|---|---|---|---|---|---|---|
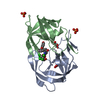
| タイトル | CRYSTALLOGRAPHIC ANALYSIS OF A COMPLEX BETWEEN HUMAN IMMUNODEFICIENCY VIRUS TYPE 1 PROTEASE AND ACETYL-PEPSTATIN AT 2.0-ANGSTROMS RESOLUTION | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / ACID PROTEINASE / HYDROLASE-HYDROLASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RNA-directed DNA polymerase activity / telomerase activity / HIV-1 retropepsin / symbiont-mediated activation of host apoptosis / retroviral ribonuclease H / exoribonuclease H / exoribonuclease H activity / host multivesicular body / DNA integration / viral genome integration into host DNA ...RNA-directed DNA polymerase activity / telomerase activity / HIV-1 retropepsin / symbiont-mediated activation of host apoptosis / retroviral ribonuclease H / exoribonuclease H / exoribonuclease H activity / host multivesicular body / DNA integration / viral genome integration into host DNA / RNA-directed DNA polymerase / establishment of integrated proviral latency / viral penetration into host nucleus / RNA stem-loop binding / RNA-DNA hybrid ribonuclease activity / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / host cell / viral nucleocapsid / endonuclease activity / DNA recombination / DNA-directed DNA polymerase / aspartic-type endopeptidase activity / 加水分解酵素; エステル加水分解酵素 / DNA-directed DNA polymerase activity / symbiont-mediated suppression of host gene expression / symbiont entry into host cell / viral translational frameshifting / lipid binding / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / proteolysis / DNA binding / zinc ion binding / membrane 類似検索 - 分子機能 | ||||||
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Streptomyces (バクテリア) Streptomyces (バクテリア) | ||||||
| 手法 |  X線回折 / 解像度: 2 Å X線回折 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Fitzgerald, P.M.D. / Mckeever, B.M. / Vanmiddlesworth, J.F. / Springer, J.P. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 1990 ジャーナル: J.Biol.Chem. / 年: 1990タイトル: Crystallographic analysis of a complex between human immunodeficiency virus type 1 protease and acetyl-pepstatin at 2.0-A resolution. 著者: Fitzgerald, P.M. / McKeever, B.M. / VanMiddlesworth, J.F. / Springer, J.P. / Heimbach, J.C. / Leu, C.T. / Herber, W.K. / Dixon, R.A. / Darke, P.L. #1:  ジャーナル: Nature / 年: 1989 ジャーナル: Nature / 年: 1989タイトル: Three-Dimensional Structure of Aspartyl Protease from Human Immunodeficiency Virus HIV-1 著者: Navia, M.A. / Fitzgerald, P.M.D. / Mckeever, B.M. / Leu, C.-T. / Heimbach, J.C. / Herber, W.K. / Sigal, I.S. / Darke, P.L. / Springer, J.P. #2:  ジャーナル: J.Biol.Chem. / 年: 1989 ジャーナル: J.Biol.Chem. / 年: 1989タイトル: Crystallization of the Aspartylprotease from the Human Immunodefeciency Virus, HIV-1 著者: Mckeever, B.M. / Navia, M.A. / Fitzgerald, P.M.D. / Springer, J.P. / Leu, C.-T. / Heimbach, J.C. / Herber, W.K. / Sigal, I.S. / Darke, P.L. #3:  ジャーナル: J.Biol.Chem. / 年: 1989 ジャーナル: J.Biol.Chem. / 年: 1989タイトル: Human Immunodeficiency Virus Protease. Bacterial Expression and Characterization of the Purified Aspartic Protease 著者: Darke, P.L. / Leu, C.-T. / Davis, L.J. / Heimabch, J.C. / Diehl, R.E. / Hill, W.S. / Dixon, R.A.F. / Sigal, I.S. | ||||||
| 履歴 |
| ||||||
| Remark 700 | SHEET THE SHEET *S1* IS FORMED BY THE INTERDIGITATING STRANDS FROM THE TWO MONOMERS OF THE DIMERIC ...SHEET THE SHEET *S1* IS FORMED BY THE INTERDIGITATING STRANDS FROM THE TWO MONOMERS OF THE DIMERIC ENZYME. STRANDS 1 AND 3 ARE FROM CHAIN *A*. STRANDS 2 AND 4 ARE FROM CHAIN *B*. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5hvp.cif.gz 5hvp.cif.gz | 57.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5hvp.ent.gz pdb5hvp.ent.gz | 42.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5hvp.json.gz 5hvp.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5hvp_validation.pdf.gz 5hvp_validation.pdf.gz | 362 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5hvp_full_validation.pdf.gz 5hvp_full_validation.pdf.gz | 366.6 KB | 表示 | |
| XML形式データ |  5hvp_validation.xml.gz 5hvp_validation.xml.gz | 6.4 KB | 表示 | |
| CIF形式データ |  5hvp_validation.cif.gz 5hvp_validation.cif.gz | 10.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hv/5hvp https://data.pdbj.org/pub/pdb/validation_reports/hv/5hvp ftp://data.pdbj.org/pub/pdb/validation_reports/hv/5hvp ftp://data.pdbj.org/pub/pdb/validation_reports/hv/5hvp | HTTPS FTP |
-関連構造データ
| 類似構造データ |
|---|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: SIDE CHAINS OF THESE RESIDUES HAVE BEEN MODELED IN TWO ALTERNATE CONFORMATIONS AND ASSIGNED ALTERNATE LOCATION INDICATORS *1* AND *2*. 2: THE OCCUPANCIES OF SOLVENT MOLECULES WHICH CORRELATED WITH STATIC DISORDER IN THE PROTEIN HAVE BEEN SET TO LESS THAN UNITY. WATER MOLECULES WITH ALTERNATE LOCATION INDICATOR *1* AND OCCUPANCY 0.58 ...2: THE OCCUPANCIES OF SOLVENT MOLECULES WHICH CORRELATED WITH STATIC DISORDER IN THE PROTEIN HAVE BEEN SET TO LESS THAN UNITY. WATER MOLECULES WITH ALTERNATE LOCATION INDICATOR *1* AND OCCUPANCY 0.58 CORRELATE WITH INHIBITOR ORIENTATIO *1*. WATER MOLECULES WITH ALTERNATE LOCATION INDICATOR *2* AND OCCUPANCY 0.42 CORRELATE WITH INHIBITOR ORIENTATION *2* IF THE SOLVENT MOLECULE IS DISTANT FROM THE BOUND INHIBITOR AN OCCUPANCY OF 0.50 HAS BEEN ASSIGNED. |
- 要素
要素
| #1: タンパク質 | 分子量: 10830.781 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)属: Lentivirus / 発現宿主:  #2: タンパク質・ペプチド | | #3: 化合物 | #4: 水 | ChemComp-HOH / | 構成要素の詳細 | THE INHIBITOR BINDS TO THE ENZYME IN TWO ROUGHLY TWOFOLD SYMMETRIC ORIENTATIONS. THE ALTERNATE ...THE INHIBITOR BINDS TO THE ENZYME IN TWO ROUGHLY TWOFOLD SYMMETRIC ORIENTATIO | Has protein modification | Y | 配列の詳細 | IN THE PAPER CITED IN THE *JRNL* RECORDS ABOVE, THE *B* CHAIN RESIDUES WERE NUMBERED FROM 201 TO ...IN THE PAPER CITED IN THE *JRNL* RECORDS ABOVE, THE *B* CHAIN RESIDUES WERE NUMBERED FROM 201 TO 299. THIS NUMBERING SCHEME HAS BEEN RETAINED. | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.63 Å3/Da / 溶媒含有率: 53.16 % | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS pH: 5.4 / 手法: 蒸気拡散法 / 詳細: macro-seeding | |||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
| 反射 | *PLUS 最高解像度: 1.92 Å / 最低解像度: 9999 Å / Num. obs: 13397 / % possible obs: 72.6 % / Observed criterion σ(I): 1 / Num. measured all: 36470 / Rmerge(I) obs: 0.0439 |
- 解析
解析
| ソフトウェア | 名称: PROLSQ / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2→8 Å / σ(I): 0 /
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 2 Å / 最低解像度: 8 Å / Num. reflection obs: 12901 / Rfactor obs: 0.176 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS |
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj





