[English] 日本語
 Yorodumi
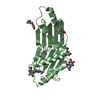
Yorodumi- PDB-5h5a: Mdm12 from K. lactis (1-239), Lys residues are uniformly dimethyl... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5h5a | ||||||
|---|---|---|---|---|---|---|---|
| Title | Mdm12 from K. lactis (1-239), Lys residues are uniformly dimethyl modified | ||||||
 Components Components | (Mitochondrial distribution and morphology protein 12) x 2 | ||||||
 Keywords Keywords | LIPID BINDING PROTEIN | ||||||
| Function / homology |  Function and homology information Function and homology informationERMES complex / protein insertion into mitochondrial outer membrane / phospholipid transport / mitochondrion-endoplasmic reticulum membrane tethering / lipid binding / endoplasmic reticulum membrane Similarity search - Function | ||||||
| Biological species |  Kluyveromyces lactis (yeast) Kluyveromyces lactis (yeast) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.26 Å MOLECULAR REPLACEMENT / Resolution: 2.26 Å | ||||||
 Authors Authors | Kawano, S. / Quinbara, S. / Endo, T. | ||||||
| Funding support |  Japan, 1items Japan, 1items
| ||||||
 Citation Citation |  Journal: J. Cell Biol. / Year: 2018 Journal: J. Cell Biol. / Year: 2018Title: Structure-function insights into direct lipid transfer between membranes by Mmm1-Mdm12 of ERMES Authors: Kawano, S. / Tamura, Y. / Kojima, R. / Bala, S. / Asai, E. / Michel, A.H. / Kornmann, B. / Riezman, I. / Riezman, H. / Sakae, Y. / Okamoto, Y. / Endo, T. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5h5a.cif.gz 5h5a.cif.gz | 187.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5h5a.ent.gz pdb5h5a.ent.gz | 147.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5h5a.json.gz 5h5a.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/h5/5h5a https://data.pdbj.org/pub/pdb/validation_reports/h5/5h5a ftp://data.pdbj.org/pub/pdb/validation_reports/h5/5h5a ftp://data.pdbj.org/pub/pdb/validation_reports/h5/5h5a | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unit cell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Noncrystallographic symmetry (NCS) | NCS domain:
NCS domain segments: Component-ID: _ / Beg auth comp-ID: HIS / Beg label comp-ID: HIS / End auth comp-ID: ASP / End label comp-ID: ASP / Refine code: _ / Auth seq-ID: 0 - 234
NCS ensembles :
|
- Components
Components
| #1: Protein | Mass: 27466.426 Da / Num. of mol.: 3 / Fragment: UNP residues 1-239 Source method: isolated from a genetically manipulated source Details: phosphatidylethanolamine Source: (gene. exp.)  Kluyveromyces lactis (strain ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37) (yeast) Kluyveromyces lactis (strain ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37) (yeast)Strain: ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37 Gene: MDM12, KLLA0C06028g / Plasmid: pET-16b / Production host:  #2: Protein | | Mass: 29499.641 Da / Num. of mol.: 1 / Fragment: UNP residues 1-239 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Kluyveromyces lactis (strain ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37) (yeast) Kluyveromyces lactis (strain ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37) (yeast)Strain: ATCC 8585 / CBS 2359 / DSM 70799 / NBRC 1267 / NRRL Y-1140 / WM37 Gene: MDM12, KLLA0C06028g / Plasmid: pET-16b / Production host:  #3: Chemical | ChemComp-6OU / [( #4: Chemical | ChemComp-K / #5: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.65 Å3/Da / Density % sol: 53.57 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / Details: 1.26M NaH2PO4, 0.14M K2HPO4 pH 5.6 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SPring-8 SPring-8  / Beamline: BL38B1 / Wavelength: 1 Å / Beamline: BL38B1 / Wavelength: 1 Å |
| Detector | Type: ADSC QUANTUM 315 / Detector: CCD / Date: Oct 26, 2012 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 2.25→50 Å / Num. obs: 527803 / % possible obs: 97.1 % / Redundancy: 3.8 % / Net I/σ(I): 11.3 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT / Resolution: 2.26→50 Å / Cor.coef. Fo:Fc: 0.929 / Cor.coef. Fo:Fc free: 0.902 / SU B: 11.647 / SU ML: 0.264 / Cross valid method: THROUGHOUT / ESU R: 0.36 / ESU R Free: 0.258 / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS MOLECULAR REPLACEMENT / Resolution: 2.26→50 Å / Cor.coef. Fo:Fc: 0.929 / Cor.coef. Fo:Fc free: 0.902 / SU B: 11.647 / SU ML: 0.264 / Cross valid method: THROUGHOUT / ESU R: 0.36 / ESU R Free: 0.258 / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 43.304 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: 1 / Resolution: 2.26→50 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller














 PDBj
PDBj