| 登録情報 | データベース: PDB / ID: 5fpf
|
|---|
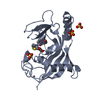
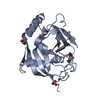
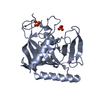
| タイトル | Crystal structure of human tankyrase 2 in complex with TA-91 |
|---|
 要素 要素 | (TANKYRASE-2) x 2 |
|---|
 キーワード キーワード | TRANSFERASE / PROTEIN-LIGAND COMPLEX / DIPHTHERIA TOXIN LIKE FOLD / ADP- RIBOSYLATION / TRANSFERASE-TRANSFERASE INHIBITOR COMPLEX |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
XAV939 stabilizes AXIN / positive regulation of telomere capping / NAD+ ADP-ribosyltransferase / protein auto-ADP-ribosylation / negative regulation of telomere maintenance via telomere lengthening / protein localization to chromosome, telomeric region / NAD+-protein-aspartate ADP-ribosyltransferase activity / protein poly-ADP-ribosylation / NAD+-protein-glutamate ADP-ribosyltransferase activity / NAD+-protein mono-ADP-ribosyltransferase activity ...XAV939 stabilizes AXIN / positive regulation of telomere capping / NAD+ ADP-ribosyltransferase / protein auto-ADP-ribosylation / negative regulation of telomere maintenance via telomere lengthening / protein localization to chromosome, telomeric region / NAD+-protein-aspartate ADP-ribosyltransferase activity / protein poly-ADP-ribosylation / NAD+-protein-glutamate ADP-ribosyltransferase activity / NAD+-protein mono-ADP-ribosyltransferase activity / pericentriolar material / 転移酵素; グリコシル基を移すもの; 五炭糖残基を移すもの / NAD+ poly-ADP-ribosyltransferase activity / positive regulation of telomere maintenance via telomerase / nucleotidyltransferase activity / TCF dependent signaling in response to WNT / Degradation of AXIN / Regulation of PTEN stability and activity / Wnt signaling pathway / protein polyubiquitination / nuclear envelope / positive regulation of canonical Wnt signaling pathway / chromosome, telomeric region / Ub-specific processing proteases / Golgi membrane / perinuclear region of cytoplasm / enzyme binding / metal ion binding / nucleus / cytoplasm / cytosol類似検索 - 分子機能 YefM-like fold / YefM-like fold - #10 / Ankyrin repeat / Phosphoenolpyruvate Carboxykinase; domain 3 - #10 / Other non-globular / Phosphoenolpyruvate Carboxykinase; domain 3 / Poly(ADP-ribose) polymerase catalytic domain / Poly(ADP-ribose) polymerase, catalytic domain / PARP catalytic domain profile. / SAM domain (Sterile alpha motif) ...YefM-like fold / YefM-like fold - #10 / Ankyrin repeat / Phosphoenolpyruvate Carboxykinase; domain 3 - #10 / Other non-globular / Phosphoenolpyruvate Carboxykinase; domain 3 / Poly(ADP-ribose) polymerase catalytic domain / Poly(ADP-ribose) polymerase, catalytic domain / PARP catalytic domain profile. / SAM domain (Sterile alpha motif) / SAM domain profile. / Sterile alpha motif. / Sterile alpha motif domain / Sterile alpha motif/pointed domain superfamily / Ankyrin repeat / Ankyrin repeats (3 copies) / Special / Ankyrin repeat profile. / Ankyrin repeat region circular profile. / ankyrin repeats / Ankyrin repeat / Ankyrin repeat-containing domain superfamily / Alpha-Beta Complex / Alpha Beta類似検索 - ドメイン・相同性 Chem-5ZI / Poly [ADP-ribose] polymerase tankyrase-2類似検索 - 構成要素 |
|---|
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.6 Å 分子置換 / 解像度: 2.6 Å |
|---|
 データ登録者 データ登録者 | Haikarainen, T. / Lehtio, L. |
|---|
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Published
タイトル: Design, Synthesis and Evaluation of Novel Dual- Binding Inhibitors of the Tankyrases and Wnt Signalling.
著者: Nathubhai, A. / Haikarainen, T. / Hayward, P.C. / Munoz-Descalzo, S. / Tosh, D. / Lloyd, M.D. / Lehtio, L. / Threadgill, M.D. |
|---|
| 履歴 | | 登録 | 2015年11月30日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2016年12月14日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 2.0 | 2017年9月27日 | Group: Atomic model / Data collection / カテゴリ: atom_site / diffrn_detector
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_atom_id / _atom_site.label_atom_id / _diffrn_detector.type |
|---|
| 改定 2.1 | 2024年1月10日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.6 Å
分子置換 / 解像度: 2.6 Å  データ登録者
データ登録者 引用
引用 ジャーナル: To be Published
ジャーナル: To be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5fpf.cif.gz
5fpf.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5fpf.ent.gz
pdb5fpf.ent.gz PDB形式
PDB形式 5fpf.json.gz
5fpf.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/fp/5fpf
https://data.pdbj.org/pub/pdb/validation_reports/fp/5fpf ftp://data.pdbj.org/pub/pdb/validation_reports/fp/5fpf
ftp://data.pdbj.org/pub/pdb/validation_reports/fp/5fpf リンク
リンク 集合体
集合体


 要素
要素 HOMO SAPIENS (ヒト) / プラスミド: PNIC28-BSA4 / 発現宿主:
HOMO SAPIENS (ヒト) / プラスミド: PNIC28-BSA4 / 発現宿主: 
 HOMO SAPIENS (ヒト) / プラスミド: PNIC28-BSA4 / 発現宿主:
HOMO SAPIENS (ヒト) / プラスミド: PNIC28-BSA4 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID29 / 波長: 0.99987
/ ビームライン: ID29 / 波長: 0.99987  解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー






















 PDBj
PDBj








