| 登録情報 | データベース: PDB / ID: 5fey
|
|---|
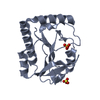
| タイトル | TRIM32 RING |
|---|
 要素 要素 | E3 ubiquitin-protein ligase TRIM32 |
|---|
 キーワード キーワード | LIGASE / E3 ligase / ubiquitin |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
actin ubiquitination / positive regulation of interleukin-17-mediated signaling pathway / positive regulation of chemokine (C-C motif) ligand 20 production / striated muscle myosin thick filament / positive regulation of striated muscle cell differentiation / suppression of viral release by host / free ubiquitin chain polymerization / negative regulation of toll-like receptor 4 signaling pathway / negative regulation of cilium assembly / positive regulation of autophagosome assembly ...actin ubiquitination / positive regulation of interleukin-17-mediated signaling pathway / positive regulation of chemokine (C-C motif) ligand 20 production / striated muscle myosin thick filament / positive regulation of striated muscle cell differentiation / suppression of viral release by host / free ubiquitin chain polymerization / negative regulation of toll-like receptor 4 signaling pathway / negative regulation of cilium assembly / positive regulation of autophagosome assembly / negative regulation of viral transcription / tissue homeostasis / Tat protein binding / negative regulation of intrinsic apoptotic signaling pathway in response to DNA damage / positive regulation of tumor necrosis factor-mediated signaling pathway / positive regulation of neurogenesis / muscle cell cellular homeostasis / positive regulation of cell motility / cellular response to stress / myosin binding / response to starvation / axon development / fat cell differentiation / positive regulation of proteolysis / response to tumor necrosis factor / autophagosome assembly / protein K63-linked ubiquitination / response to UV / negative regulation of fibroblast proliferation / positive regulation of cell cycle / translation initiation factor binding / positive regulation of autophagy / positive regulation of neuron differentiation / Regulation of innate immune responses to cytosolic DNA / cellular response to amino acid starvation / autophagosome / positive regulation of DNA-binding transcription factor activity / ubiquitin binding / RING-type E3 ubiquitin transferase / protein polyubiquitination / positive regulation of protein catabolic process / positive regulation of NF-kappaB transcription factor activity / ubiquitin-protein transferase activity / ubiquitin protein ligase activity / Antigen processing: Ubiquitination & Proteasome degradation / positive regulation of cell growth / ubiquitin-dependent protein catabolic process / protein-macromolecule adaptor activity / response to oxidative stress / positive regulation of canonical NF-kappaB signal transduction / transcription coactivator activity / protein ubiquitination / positive regulation of cell migration / innate immune response / centrosome / endoplasmic reticulum / mitochondrion / RNA binding / zinc ion binding / identical protein binding / nucleus / cytosol / cytoplasm類似検索 - 分子機能 : / NHL repeat profile. / NHL repeat / NHL repeat / Zinc finger, RING-type, eukaryotic / RING-type zinc-finger / B-Box-type zinc finger / B-box-type zinc finger / Zinc finger B-box type profile. / Six-bladed beta-propeller, TolB-like ...: / NHL repeat profile. / NHL repeat / NHL repeat / Zinc finger, RING-type, eukaryotic / RING-type zinc-finger / B-Box-type zinc finger / B-box-type zinc finger / Zinc finger B-box type profile. / Six-bladed beta-propeller, TolB-like / Zinc/RING finger domain, C3HC4 (zinc finger) / Herpes Virus-1 / Zinc finger, RING-type, conserved site / Zinc finger RING-type signature. / Ring finger / Zinc finger RING-type profile. / Zinc finger, RING-type / Zinc finger, RING/FYVE/PHD-type / 2-Layer Sandwich / Alpha Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 2.23 Å シンクロトロン / 解像度: 2.23 Å |
|---|
 データ登録者 データ登録者 | Rittinger, K. / Esposito, D. / Koliopoulos, M.G. |
|---|
| 資金援助 |  英国, 2件 英国, 2件 | 組織 | 認可番号 | 国 |
|---|
| Medical Research Council (United Kingdom) | U117565398 |  英国 英国 | | The Francis Crick Institute | FCI01 |  英国 英国 |
|
|---|
 引用 引用 |  ジャーナル: Embo J. / 年: 2016 ジャーナル: Embo J. / 年: 2016
タイトル: Functional role of TRIM E3 ligase oligomerization and regulation of catalytic activity.
著者: Koliopoulos, M.G. / Esposito, D. / Christodoulou, E. / Taylor, I.A. / Rittinger, K. |
|---|
| 履歴 | | 登録 | 2015年12月17日 | 登録サイト: RCSB / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2016年5月18日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2016年6月15日 | Group: Database references |
|---|
| 改定 1.2 | 2017年9月13日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.3 | 2024年5月8日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン / 解像度: 2.23 Å
シンクロトロン / 解像度: 2.23 Å  データ登録者
データ登録者 英国, 2件
英国, 2件  引用
引用 ジャーナル: Embo J. / 年: 2016
ジャーナル: Embo J. / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5fey.cif.gz
5fey.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5fey.ent.gz
pdb5fey.ent.gz PDB形式
PDB形式 5fey.json.gz
5fey.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/fe/5fey
https://data.pdbj.org/pub/pdb/validation_reports/fe/5fey ftp://data.pdbj.org/pub/pdb/validation_reports/fe/5fey
ftp://data.pdbj.org/pub/pdb/validation_reports/fe/5fey リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: TRIM32, HT2A / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: TRIM32, HT2A / 発現宿主: 
 X線回折
X線回折 試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID29 / 波長: 1.28254 Å
/ ビームライン: ID29 / 波長: 1.28254 Å 解析
解析 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj











