+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5elv | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of the GluA2 ligand-binding domain (S1S2J-L504-N775) in complex with glutamate and BPAM-521 at 1.92 A resolution | ||||||
 要素 要素 | Glutamate receptor 2,Glutamate receptor 2 | ||||||
 キーワード キーワード | MEMBRANE PROTEIN / AMPA RECEPTOR LIGAND-BINDING DOMAIN / BPAM-521 ALLOSTERIC MODULATION / FUSION PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報spine synapse / dendritic spine neck / dendritic spine head / cellular response to amine stimulus / perisynaptic space / Activation of AMPA receptors / ligand-gated monoatomic cation channel activity / AMPA glutamate receptor activity / response to lithium ion / Trafficking of GluR2-containing AMPA receptors ...spine synapse / dendritic spine neck / dendritic spine head / cellular response to amine stimulus / perisynaptic space / Activation of AMPA receptors / ligand-gated monoatomic cation channel activity / AMPA glutamate receptor activity / response to lithium ion / Trafficking of GluR2-containing AMPA receptors / kainate selective glutamate receptor activity / cellular response to glycine / AMPA glutamate receptor complex / extracellularly glutamate-gated ion channel activity / immunoglobulin binding / asymmetric synapse / ionotropic glutamate receptor complex / conditioned place preference / regulation of receptor recycling / glutamate receptor binding / Unblocking of NMDA receptors, glutamate binding and activation / positive regulation of synaptic transmission / regulation of synaptic transmission, glutamatergic / response to fungicide / cytoskeletal protein binding / glutamate-gated receptor activity / regulation of long-term synaptic depression / cellular response to brain-derived neurotrophic factor stimulus / extracellular ligand-gated monoatomic ion channel activity / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / somatodendritic compartment / dendrite membrane / ionotropic glutamate receptor binding / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / ionotropic glutamate receptor signaling pathway / dendrite cytoplasm / synaptic membrane / dendritic shaft / SNARE binding / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / synaptic transmission, glutamatergic / PDZ domain binding / protein tetramerization / establishment of protein localization / postsynaptic density membrane / cerebral cortex development / modulation of chemical synaptic transmission / receptor internalization / Schaffer collateral - CA1 synapse / terminal bouton / synaptic vesicle / synaptic vesicle membrane / signaling receptor activity / presynapse / amyloid-beta binding / growth cone / presynaptic membrane / scaffold protein binding / perikaryon / dendritic spine / chemical synaptic transmission / postsynaptic membrane / neuron projection / postsynaptic density / axon / external side of plasma membrane / neuronal cell body / synapse / dendrite / protein kinase binding / protein-containing complex binding / glutamatergic synapse / cell surface / endoplasmic reticulum / protein-containing complex / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.92 Å 分子置換 / 解像度: 1.92 Å | ||||||
 データ登録者 データ登録者 | Krintel, C. / Juknaite, L. / Frydenvang, K. / Kastrup, J.S. | ||||||
 引用 引用 |  ジャーナル: Biophys.J. / 年: 2016 ジャーナル: Biophys.J. / 年: 2016タイトル: Enthalpy-Entropy Compensation in the Binding of Modulators at Ionotropic Glutamate Receptor GluA2. 著者: Krintel, C. / Francotte, P. / Pickering, D.S. / Juknaite, L. / Phlsgaard, J. / Olsen, L. / Frydenvang, K. / Goffin, E. / Pirotte, B. / Kastrup, J.S. #1:  ジャーナル: J. Med. Chem. / 年: 2013 ジャーナル: J. Med. Chem. / 年: 2013タイトル: Synthesis, pharmacological and structural characterization, and thermodynamic aspects of GluA2-positive allosteric modulators with a 3,4-dihydro-2H-1,2,4-benzothiadiazine 1,1-dioxide scaffold. 著者: Noerholm, A.B. / Francotte, P. / Olsen, L. / Krintel, C. / Frydenvang, K. / Goffin, E. / Challal, S. / Danober, L. / Botez-Pop, I. / Lestage, P. / Pirotte, B. / Kastrup, J.S. #2:  ジャーナル: Biochem. J. / 年: 2012 ジャーナル: Biochem. J. / 年: 2012タイトル: Thermodynamics and structural analysis of positive allosteric modulation of the ionotropic glutamate receptor GluA2. 著者: Krintel, C. / Frydenvang, K. / Olsen, L. / Kristensen, M.T. / de Barrios, O. / Naur, P. / Francotte, P. / Pirotte, B. / Gajhede, M. / Kastrup, J.S. #3:  ジャーナル: J. Med. Chem. / 年: 2014 ジャーナル: J. Med. Chem. / 年: 2014タイトル: Positive allosteric modulators of 2-amino-3-(3-hydroxy-5-methylisoxazol-4-yl)propionic acid receptors belonging to 4-cyclopropyl-3,4-dihydro-2h-1,2,4-pyridothiadiazine dioxides and ...タイトル: Positive allosteric modulators of 2-amino-3-(3-hydroxy-5-methylisoxazol-4-yl)propionic acid receptors belonging to 4-cyclopropyl-3,4-dihydro-2h-1,2,4-pyridothiadiazine dioxides and diversely chloro-substituted 4-cyclopropyl-3,4-dihydro-2H-1,2,4-benzothiadiazine 1,1-dioxides. 著者: Francotte, P. / Noerholm, A.B. / Deva, T. / Olsen, L. / Frydenvang, K. / Goffin, E. / Fraikin, P. / de Tullio, P. / Challal, S. / Thomas, J.Y. / Iop, F. / Louis, C. / Botez-Pop, I. / Lestage, ...著者: Francotte, P. / Noerholm, A.B. / Deva, T. / Olsen, L. / Frydenvang, K. / Goffin, E. / Fraikin, P. / de Tullio, P. / Challal, S. / Thomas, J.Y. / Iop, F. / Louis, C. / Botez-Pop, I. / Lestage, P. / Danober, L. / Kastrup, J.S. / Pirotte, B. #4:  ジャーナル: Biochemistry / 年: 2009 ジャーナル: Biochemistry / 年: 2009タイトル: Probing the allosteric modulator binding site of GluR2 with thiazide derivatives. 著者: Ptak, C.P. / Ahmed, A.H. / Oswald, R.E. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5elv.cif.gz 5elv.cif.gz | 135.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5elv.ent.gz pdb5elv.ent.gz | 104.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5elv.json.gz 5elv.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/el/5elv https://data.pdbj.org/pub/pdb/validation_reports/el/5elv ftp://data.pdbj.org/pub/pdb/validation_reports/el/5elv ftp://data.pdbj.org/pub/pdb/validation_reports/el/5elv | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  3tdjS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 29301.729 Da / 分子数: 2 / 断片: UNP residues, 413-527,UNP residue, 653-797 / 変異: L504Y and N775S / 由来タイプ: 組換発現 詳細: THE PROTEIN COMPRISES SEGMENT S1 RESIDUES 413-527, A GT LINKER AND S2 RESIDUES 653-798. 由来: (組換発現)   |
|---|
-非ポリマー , 8種, 469分子 



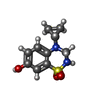










| #2: 化合物 | ChemComp-SO4 / #3: 化合物 | ChemComp-GOL / #4: 化合物 | #5: 化合物 | ChemComp-ACT / #6: 化合物 | #7: 化合物 | #8: 化合物 | #9: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.46 Å3/Da / 溶媒含有率: 49.97 % |
|---|---|
| 結晶化 | 温度: 279 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 4.5 詳細: 20% PEG4000, 0.3 M lithium sulfate and 0.1 M phosphate-citrate |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  MAX II MAX II  / ビームライン: I911-3 / 波長: 0.9753 Å / ビームライン: I911-3 / 波長: 0.9753 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: MARMOSAIC 225 mm CCD / 検出器: CCD / 日付: 2011年12月15日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.9753 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.92→34.25 Å / Num. all: 44908 / Num. obs: 44908 / % possible obs: 99.9 % / 冗長度: 5.1 % / Biso Wilson estimate: 14.19 Å2 / Rpim(I) all: 0.041 / Rrim(I) all: 0.097 / Rsym value: 0.088 / Net I/av σ(I): 5.166 / Net I/σ(I): 13.4 / Num. measured all: 228349 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1 / Rejects: _
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 |
|---|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3TDJ 解像度: 1.92→31.801 Å / SU ML: 0.19 / 交差検証法: THROUGHOUT / σ(F): 0 / 位相誤差: 20.36 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 82.71 Å2 / Biso mean: 17.8297 Å2 / Biso min: 1.5 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.92→31.801 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 16
|
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj












