[English] 日本語
 Yorodumi
Yorodumi- PDB-5byl: Aminoglycoside Phosphotransferase (2'')-Ia (CTD of AAC(6')-Ie/APH... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5byl | ||||||
|---|---|---|---|---|---|---|---|
| Title | Aminoglycoside Phosphotransferase (2'')-Ia (CTD of AAC(6')-Ie/APH(2'')-Ia) in complex with GMPPCP and Magnesium | ||||||
 Components Components | Bifunctional AAC/APH | ||||||
 Keywords Keywords | TRANSFERASE / Kinase / Antibiotic / Aminoglycoside / Resistance | ||||||
| Function / homology |  Function and homology information Function and homology informationaminoglycoside 2''-phosphotransferase / aminoglycoside phosphotransferase activity / N-acyltransferase activity / Transferases; Acyltransferases; Transferring groups other than aminoacyl groups / response to antibiotic / ATP binding / cytoplasm Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  FOURIER SYNTHESIS / Resolution: 2.15 Å FOURIER SYNTHESIS / Resolution: 2.15 Å | ||||||
 Authors Authors | Caldwell, S.J. / Berghuis, A.M. | ||||||
| Funding support |  Canada, 1items Canada, 1items
| ||||||
 Citation Citation |  Journal: Structure / Year: 2016 Journal: Structure / Year: 2016Title: Antibiotic Binding Drives Catalytic Activation of Aminoglycoside Kinase APH(2)-Ia. Authors: Caldwell, S.J. / Huang, Y. / Berghuis, A.M. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5byl.cif.gz 5byl.cif.gz | 538.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5byl.ent.gz pdb5byl.ent.gz | 442.8 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5byl.json.gz 5byl.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/by/5byl https://data.pdbj.org/pub/pdb/validation_reports/by/5byl ftp://data.pdbj.org/pub/pdb/validation_reports/by/5byl ftp://data.pdbj.org/pub/pdb/validation_reports/by/5byl | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5iqaC  5iqbC  5iqcC  5iqdC  5iqeC  5iqfC  5iqgC  5iqhC  5iqiC C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 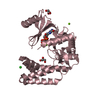
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unit cell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Noncrystallographic symmetry (NCS) | NCS domain:
NCS domain segments: Component-ID: _ / Refine code: _
NCS ensembles :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Details | SAXS |
- Components
Components
-Protein , 1 types, 4 molecules ABCD
| #1: Protein | Mass: 35948.199 Da / Num. of mol.: 4 / Fragment: C-terminal domain (UNP residues 175-479) Source method: isolated from a genetically manipulated source Details: C-terminal domain of AAC(6')-Ie/APH(2'')-Ia bifunctional enzyme, residues 175-479 Source: (gene. exp.)   References: UniProt: P0A0C1, Transferases; Acyltransferases; Transferring groups other than aminoacyl groups, Transferases; Transferring phosphorus-containing groups; Phosphotransferases with an alcohol group as acceptor |
|---|
-Non-polymers , 5 types, 1081 molecules 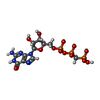








| #2: Chemical | ChemComp-GCP / #3: Chemical | ChemComp-MG / #4: Chemical | #5: Chemical | ChemComp-GOL / #6: Water | ChemComp-HOH / | |
|---|
-Details
| Has protein modification | N |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.84 Å3/Da / Density % sol: 56.62 % |
|---|---|
| Crystal grow | Temperature: 296 K / Method: vapor diffusion, hanging drop / pH: 7.5 Details: 80-120mM MgCl2, 8% Glycerol, 10% PEG3350, 100mM HEPES pH 7.5 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  CLSI CLSI  / Beamline: 08ID-1 / Wavelength: 0.9795 Å / Beamline: 08ID-1 / Wavelength: 0.9795 Å |
| Detector | Type: RAYONIX MX-300 / Detector: CCD / Date: Nov 26, 2013 |
| Radiation | Monochromator: ACCEL/BRUKER double crystal monochromator (DCM), featuring indirectly cryo-cooled first crystal and sagittally focusing second crystal Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9795 Å / Relative weight: 1 |
| Reflection | Resolution: 2.15→58.92 Å / Num. obs: 82837 / % possible obs: 95 % / Redundancy: 3.9 % / Rmerge(I) obs: 0.091 / Net I/av σ(I): 3.8 / Net I/σ(I): 12.3 |
| Reflection shell | Resolution: 2.15→2.19 Å / Redundancy: 3.8 % / Rmerge(I) obs: 0.532 / Mean I/σ(I) obs: 2.6 / % possible all: 65.6 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  FOURIER SYNTHESIS FOURIER SYNTHESISStarting model: APH(2'')-Ia GMPPNP-Mg complex Resolution: 2.15→58.92 Å / Cor.coef. Fo:Fc: 0.97 / Cor.coef. Fo:Fc free: 0.954 / Cross valid method: THROUGHOUT / ESU R: 0.197 / ESU R Free: 0.166 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: Authors state that MG 700 and GCP 500 of chain C have a clash that appears to be a consequence of multiple discrete states in the active site. Refinement of multiple occupancy MG 700 ...Details: Authors state that MG 700 and GCP 500 of chain C have a clash that appears to be a consequence of multiple discrete states in the active site. Refinement of multiple occupancy MG 700 diverged from physiologically sensible positions, and so the single occupancy was retained, despite this clash.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 47.77 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.15→58.92 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller

















 PDBj
PDBj





