登録情報 データベース : PDB / ID : 4q6fタイトル Crystal structure of human BAZ2A PHD zinc finger in complex with unmodified H3K4 histone peptide Bromodomain adjacent to zinc finger domain protein 2A unmodified H3K4 peptide キーワード / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 1.91 Å データ登録者 Tallant, C. / Overvoorde, L. / Krojer, T. / Filippakopoulos, P. / von Delft, F. / Arrowsmith, C.H. / Edwards, A.M. / Bountra, C. / Ciulli, A. / Knapp, S. / Structural Genomics Consortium (SGC) ジャーナル : Structure / 年 : 2015タイトル : Molecular basis of histone tail recognition by human TIP5 PHD finger and bromodomain of the chromatin remodeling complex NoRC.著者 : Cynthia Tallant / Erica Valentini / Oleg Fedorov / Lois Overvoorde / Fleur M Ferguson / Panagis Filippakopoulos / Dmitri I Svergun / Stefan Knapp / Alessio Ciulli / 要旨 : Binding of the chromatin remodeling complex NoRC to RNA complementary to the rDNA promoter mediates transcriptional repression. TIP5, the largest subunit of NoRC, is involved in recruitment to rDNA ... Binding of the chromatin remodeling complex NoRC to RNA complementary to the rDNA promoter mediates transcriptional repression. TIP5, the largest subunit of NoRC, is involved in recruitment to rDNA by interactions with promoter-bound TTF-I, pRNA, and acetylation of H4K16. TIP5 domains that recognize posttranslational modifications on histones are essential for recruitment of NoRC to chromatin, but how these reader modules recognize site-specific histone tails has remained elusive. Here, we report crystal structures of PHD zinc finger and bromodomains from human TIP5 and BAZ2B in free form and bound to H3 and/or H4 histones. PHD finger functions as an independent structural module in recognizing unmodified H3 histone tails, and the bromodomain prefers H3 and H4 acetylation marks followed by a key basic residue, KacXXR. Further low-resolution analyses of PHD-bromodomain modules provide molecular insights into their trans histone tail recognition, required for nucleosome recruitment and transcriptional repression of the NoRC complex. 履歴 登録 2014年4月22日 登録サイト / 処理サイト 改定 1.0 2014年5月21日 Provider / タイプ 改定 1.1 2015年4月22日 Group 改定 1.2 2024年2月28日 Group / Database references / Derived calculationsカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_asym_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.91 Å
分子置換 / 解像度: 1.91 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2015
ジャーナル: Structure / 年: 2015

 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4q6f.cif.gz
4q6f.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4q6f.ent.gz
pdb4q6f.ent.gz PDB形式
PDB形式 4q6f.json.gz
4q6f.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4q6f_validation.pdf.gz
4q6f_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4q6f_full_validation.pdf.gz
4q6f_full_validation.pdf.gz 4q6f_validation.xml.gz
4q6f_validation.xml.gz 4q6f_validation.cif.gz
4q6f_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/q6/4q6f
https://data.pdbj.org/pub/pdb/validation_reports/q6/4q6f ftp://data.pdbj.org/pub/pdb/validation_reports/q6/4q6f
ftp://data.pdbj.org/pub/pdb/validation_reports/q6/4q6f リンク
リンク 集合体
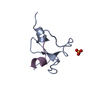
集合体


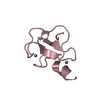

 要素
要素 Homo sapiens (ヒト) / 遺伝子: BAZ2A, KIAA0314, TIP5 / プラスミド: pET15b / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: BAZ2A, KIAA0314, TIP5 / プラスミド: pET15b / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I03 / 波長: 0.97626 Å
/ ビームライン: I03 / 波長: 0.97626 Å 解析
解析 分子置換 / 解像度: 1.91→29.06 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.952 / SU B: 5.448 / SU ML: 0.096 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.14 / ESU R Free: 0.132 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
分子置換 / 解像度: 1.91→29.06 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.952 / SU B: 5.448 / SU ML: 0.096 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.14 / ESU R Free: 0.132 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj







