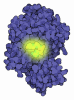
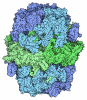
登録情報 データベース : PDB / ID : 4mrtタイトル Structure of the Phosphopantetheine Transferase Sfp in Complex with Coenzyme A and a Peptidyl Carrier Protein 4'-phosphopantetheinyl transferase sfp Tyrocidine synthase 3 キーワード / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Brevibacillus parabrevis (バクテリア)Bacillus subtilis subsp. subtilis (枯草菌)手法 / / / 解像度 : 2 Å データ登録者 Tufar, P. / Rahighi, S. / Kraas, F.I. / Kirchner, D.K. / Loehr, F. / Henrich, E. / Koepke, J. / Dikic, I. / Guentert, P. / Marahiel, M.A. / Doetsch, V. ジャーナル : Chem.Biol. / 年 : 2014タイトル : Crystal Structure of a PCP/Sfp Complex Reveals the Structural Basis for Carrier Protein Posttranslational Modification.著者 : Tufar, P. / Rahighi, S. / Kraas, F.I. / Kirchner, D.K. / Lohr, F. / Henrich, E. / Kopke, J. / Dikic, I. / Guntert, P. / Marahiel, M.A. / Dotsch, V. 履歴 登録 2013年9月17日 登録サイト / 処理サイト 改定 1.0 2014年4月23日 Provider / タイプ 改定 1.1 2014年5月14日 Group 改定 1.2 2024年2月28日 Group / Database references / Derived calculationsカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Brevibacillus parabrevis (バクテリア)
Brevibacillus parabrevis (バクテリア)
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2 Å
分子置換 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Chem.Biol. / 年: 2014
ジャーナル: Chem.Biol. / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4mrt.cif.gz
4mrt.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4mrt.ent.gz
pdb4mrt.ent.gz PDB形式
PDB形式 4mrt.json.gz
4mrt.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4mrt_validation.pdf.gz
4mrt_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4mrt_full_validation.pdf.gz
4mrt_full_validation.pdf.gz 4mrt_validation.xml.gz
4mrt_validation.xml.gz 4mrt_validation.cif.gz
4mrt_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/mr/4mrt
https://data.pdbj.org/pub/pdb/validation_reports/mr/4mrt ftp://data.pdbj.org/pub/pdb/validation_reports/mr/4mrt
ftp://data.pdbj.org/pub/pdb/validation_reports/mr/4mrt リンク
リンク 集合体
集合体
 要素
要素 Brevibacillus parabrevis (バクテリア)
Brevibacillus parabrevis (バクテリア)



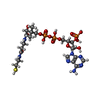







 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SLS
SLS  / ビームライン: X06DA / 波長: 1 Å
/ ビームライン: X06DA / 波長: 1 Å 分子置換
分子置換 解析
解析 分子置換 / 解像度: 2→37.91 Å / Cor.coef. Fo:Fc: 0.954 / Cor.coef. Fo:Fc free: 0.934 / WRfactor Rfree: 0.2531 / WRfactor Rwork: 0.2036 / Occupancy max: 1 / Occupancy min: 0.5 / FOM work R set: 0.8521 / SU B: 4.467 / SU ML: 0.124 / SU R Cruickshank DPI: 0.1998 / SU Rfree: 0.1709 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.2 / ESU R Free: 0.171 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD
分子置換 / 解像度: 2→37.91 Å / Cor.coef. Fo:Fc: 0.954 / Cor.coef. Fo:Fc free: 0.934 / WRfactor Rfree: 0.2531 / WRfactor Rwork: 0.2036 / Occupancy max: 1 / Occupancy min: 0.5 / FOM work R set: 0.8521 / SU B: 4.467 / SU ML: 0.124 / SU R Cruickshank DPI: 0.1998 / SU Rfree: 0.1709 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.2 / ESU R Free: 0.171 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj