| 登録情報 | データベース: PDB / ID: 4k5z
|
|---|
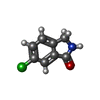
| タイトル | Crystal Structure of Human Chymase in Complex with Fragment Inhibitor 6-chloro-2,3-dihydro-1H-isoindol-1-one |
|---|
 要素 要素 | Chymase |
|---|
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / serine protease / glycosylated / Mast cells / secreted / HYDROLASE-HYDROLASE INHIBITOR complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
chymase / basement membrane disassembly / cytokine precursor processing / peptide metabolic process / Activation of Matrix Metalloproteinases / midbrain development / extracellular matrix disassembly / Metabolism of Angiotensinogen to Angiotensins / angiotensin maturation / serine-type peptidase activity ...chymase / basement membrane disassembly / cytokine precursor processing / peptide metabolic process / Activation of Matrix Metalloproteinases / midbrain development / extracellular matrix disassembly / Metabolism of Angiotensinogen to Angiotensins / angiotensin maturation / serine-type peptidase activity / peptide binding / secretory granule / protein maturation / cellular response to glucose stimulus / protein catabolic process / Signaling by SCF-KIT / cytoplasmic ribonucleoprotein granule / positive regulation of angiogenesis / : / regulation of inflammatory response / endopeptidase activity / serine-type endopeptidase activity / extracellular space / extracellular region / cytosol類似検索 - 分子機能 Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases ...Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases / Thrombin, subunit H / Peptidase S1, PA clan, chymotrypsin-like fold / Peptidase S1, PA clan / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 6-chloro-2,3-dihydro-1H-isoindol-1-one / Chymase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  フーリエ合成 / 解像度: 1.8 Å フーリエ合成 / 解像度: 1.8 Å |
|---|
 データ登録者 データ登録者 | Collins, B.K. / Padyana, A.K. |
|---|
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2013タイトル ジャーナル: J.Med.Chem. / 年: 2013タイトル: Discovery of Potent, Selective Chymase Inhibitors via Fragment Linking Strategies. 著者: Taylor, S.J. / Padyana, A.K. / Abeywardane, A. / Liang, S. / Hao, M.H. / De Lombaert, S. / Proudfoot, J. / Farmer, B.S. / Li, X. / Collins, B. / Martin, L. / Albaugh, D.R. / Hill-Drzewi, M. / ...著者: Taylor, S.J. / Padyana, A.K. / Abeywardane, A. / Liang, S. / Hao, M.H. / De Lombaert, S. / Proudfoot, J. / Farmer, B.S. / Li, X. / Collins, B. / Martin, L. / Albaugh, D.R. / Hill-Drzewi, M. / Pullen, S.S. / Takahashi, H.#1:  ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011タイトル ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011タイトル: Benzimidazolone as potent chymase inhibitor: modulation of reactive metabolite formation in the hydrophobic (P1) region. 著者: Lo, H.Y. / Nemoto, P.A. / Kim, J.M. / Hao, M.H. / Qian, K.C. / Farrow, N.A. / Albaugh, D.R. / Fowler, D.M. / Schneiderman, R.D. / Michael August, E. / Martin, L. / Hill-Drzewi, M. / Pullen, S. ...著者: Lo, H.Y. / Nemoto, P.A. / Kim, J.M. / Hao, M.H. / Qian, K.C. / Farrow, N.A. / Albaugh, D.R. / Fowler, D.M. / Schneiderman, R.D. / Michael August, E. / Martin, L. / Hill-Drzewi, M. / Pullen, S.S. / Takahashi, H. / De Lombaert, S. |
|---|
| 履歴 | | 登録 | 2013年4月15日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2013年5月29日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2013年7月3日 | Group: Database references |
|---|
| 改定 1.2 | 2020年7月29日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _chem_comp.name / _chem_comp.type ..._chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.3 | 2024年11月20日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  フーリエ合成 / 解像度: 1.8 Å
フーリエ合成 / 解像度: 1.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Med.Chem. / 年: 2013
ジャーナル: J.Med.Chem. / 年: 2013 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011
ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4k5z.cif.gz
4k5z.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4k5z.ent.gz
pdb4k5z.ent.gz PDB形式
PDB形式 4k5z.json.gz
4k5z.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4k5z_validation.pdf.gz
4k5z_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4k5z_full_validation.pdf.gz
4k5z_full_validation.pdf.gz 4k5z_validation.xml.gz
4k5z_validation.xml.gz 4k5z_validation.cif.gz
4k5z_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/k5/4k5z
https://data.pdbj.org/pub/pdb/validation_reports/k5/4k5z ftp://data.pdbj.org/pub/pdb/validation_reports/k5/4k5z
ftp://data.pdbj.org/pub/pdb/validation_reports/k5/4k5z リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: CMA1, CYH, CYM / プラスミド: pDest1393
Homo sapiens (ヒト) / 遺伝子: CMA1, CYH, CYM / プラスミド: pDest1393
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.5418 Å 解析
解析 フーリエ合成 / 解像度: 1.8→74.609 Å / Occupancy max: 1 / Occupancy min: 0.42 / SU ML: 0.24 / 交差検証法: THROUGHOUT / σ(F): 1.33 / 位相誤差: 27.02 / 立体化学のターゲット値: ML
フーリエ合成 / 解像度: 1.8→74.609 Å / Occupancy max: 1 / Occupancy min: 0.42 / SU ML: 0.24 / 交差検証法: THROUGHOUT / σ(F): 1.33 / 位相誤差: 27.02 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj