| 登録情報 | データベース: PDB / ID: 4f8l
|
|---|
| タイトル | X-ray structure of PsaA from Yersinia pestis, in complex with galactose and AEBSF |
|---|
 要素 要素 | pH 6 antigen |
|---|
 キーワード キーワード | CELL ADHESION/inhibitor / Antigens / Bacterial Proteins / Fimbriae / Molecular Sequence Data / Protein Folding / All Beta-strand / Ig-fold / Adhesion / CELL ADHESION-inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
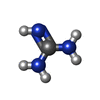
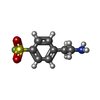
Immunoglobulin-like - #3590 / : / : / Ph 6 antigen / Prokaryotic membrane lipoprotein lipid attachment site profile. / Immunoglobulin-like / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 4-(2-AMINOETHYL)BENZENESULFONYL FLUORIDE / BROMIDE ION / GUANIDINE / beta-D-galactopyranose / GLYCINE / MALONATE ION / pH 6 antigen類似検索 - 構成要素 |
|---|
| 生物種 |   Yersinia pestis (ペスト菌) Yersinia pestis (ペスト菌) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単一同系置換・異常分散 / 解像度: 1.5 Å 単一同系置換・異常分散 / 解像度: 1.5 Å |
|---|
 データ登録者 データ登録者 | Bao, R. / Esser, L. / Xia, D. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013
タイトル: Structural basis for the specific recognition of dual receptors by the homopolymeric pH 6 antigen (Psa) fimbriae of Yersinia pestis.
著者: Bao, R. / Nair, M.K. / Tang, W.K. / Esser, L. / Sadhukhan, A. / Holland, R.L. / Xia, D. / Schifferli, D.M. |
|---|
| 履歴 | | 登録 | 2012年5月17日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2013年5月22日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2013年8月7日 | Group: Database references |
|---|
| 改定 1.2 | 2017年8月16日 | Group: Refinement description / Source and taxonomy / カテゴリ: entity_src_gen / software / Item: _software.classification |
|---|
| 改定 1.3 | 2017年11月15日 | Group: Refinement description / カテゴリ: software / Item: _software.name |
|---|
| 改定 1.4 | 2020年7月29日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / pdbx_struct_special_symmetry / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _chem_comp.name / _chem_comp.type ..._chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.5 | 2024年2月28日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  単一同系置換・異常分散 / 解像度: 1.5 Å
単一同系置換・異常分散 / 解像度: 1.5 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4f8l.cif.gz
4f8l.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4f8l.ent.gz
pdb4f8l.ent.gz PDB形式
PDB形式 4f8l.json.gz
4f8l.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/f8/4f8l
https://data.pdbj.org/pub/pdb/validation_reports/f8/4f8l ftp://data.pdbj.org/pub/pdb/validation_reports/f8/4f8l
ftp://data.pdbj.org/pub/pdb/validation_reports/f8/4f8l リンク
リンク 集合体
集合体
 要素
要素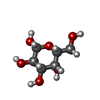












 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 0.9
/ ビームライン: 22-ID / 波長: 0.9  単一同系置換・異常分散
単一同系置換・異常分散 解析
解析 単一同系置換・異常分散 / 解像度: 1.5→27.08 Å / Occupancy max: 1 / Occupancy min: 0.26 / SU ML: 0.3 / σ(F): 1.35 / 位相誤差: 17.02 / 立体化学のターゲット値: ML
単一同系置換・異常分散 / 解像度: 1.5→27.08 Å / Occupancy max: 1 / Occupancy min: 0.26 / SU ML: 0.3 / σ(F): 1.35 / 位相誤差: 17.02 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj
















