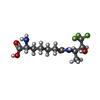
Entry Database : PDB / ID : 3zczTitle Crystal structure of a complex between Actinomadura R39 DD-peptidase and a trifluoroketone inhibitor D-ALANYL-D-ALANINE CARBOXYPEPTIDASE Keywords / / Function / homology Function Domain/homology Component
/ / / / / / / / / / / / / / / / Biological species ACTINOMADURA SP. R39 (bacteria)Method / / / Resolution : 2.6 Å Authors Sauvage, E. / Herman, R. / Kerff, F. / Rocaboy, M. / Charlier, P. Journal : Biochemistry / Year : 2013Title : Inhibition of Dd-Peptidases by a Specific Trifluoroketone: Crystal Structure of a Complex with the Actinomadura R39 Dd-Peptidase.Authors : Dzhekieva, L. / Adediran, S.A. / Herman, R. / Kerff, F. / Duez, C. / Charlier, P. / Sauvage, E. / Pratt, R.F. History Deposition Nov 23, 2012 Deposition site / Processing site Revision 1.0 Mar 27, 2013 Provider / Type Revision 1.1 Aug 28, 2013 Group Revision 1.2 Dec 20, 2023 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Other / Refinement description Category chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id Revision 1.3 Nov 13, 2024 Group / Category / pdbx_modification_feature
Show all Show less
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information ACTINOMADURA SP. R39 (bacteria)
ACTINOMADURA SP. R39 (bacteria) X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  SIRAS / Resolution: 2.6 Å
SIRAS / Resolution: 2.6 Å  Authors
Authors Citation
Citation Journal: Biochemistry / Year: 2013
Journal: Biochemistry / Year: 2013 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 3zcz.cif.gz
3zcz.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb3zcz.ent.gz
pdb3zcz.ent.gz PDB format
PDB format 3zcz.json.gz
3zcz.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/zc/3zcz
https://data.pdbj.org/pub/pdb/validation_reports/zc/3zcz ftp://data.pdbj.org/pub/pdb/validation_reports/zc/3zcz
ftp://data.pdbj.org/pub/pdb/validation_reports/zc/3zcz
 Links
Links Assembly
Assembly




 Components
Components ACTINOMADURA SP. R39 (bacteria)
ACTINOMADURA SP. R39 (bacteria) X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  SOLEIL
SOLEIL  / Beamline: PROXIMA 1 / Wavelength: 0.9801
/ Beamline: PROXIMA 1 / Wavelength: 0.9801  Processing
Processing SIRAS
SIRAS Movie
Movie Controller
Controller






















 PDBj
PDBj