| 登録情報 | データベース: PDB / ID: 3ceh
|
|---|
| タイトル | Human liver glycogen phosphorylase (tense state) in complex with the allosteric inhibitor AVE5688 |
|---|
 要素 要素 | Glycogen phosphorylase, liver form |
|---|
 キーワード キーワード | TRANSFERASE / protein ligand complex / tense state / allosteric inhibitor / Allosteric enzyme / Carbohydrate metabolism / Disease mutation / Glycogen metabolism / Glycogen storage disease / Glycosyltransferase / Nucleotide-binding / Phosphoprotein / Pyridoxal phosphate |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
purine nucleobase binding / vitamin binding / D-glucose binding / glycogen phosphorylase / glycogen phosphorylase activity / bile acid binding / glycogen catabolic process / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / AMP binding ...purine nucleobase binding / vitamin binding / D-glucose binding / glycogen phosphorylase / glycogen phosphorylase activity / bile acid binding / glycogen catabolic process / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / AMP binding / necroptotic process / response to bacterium / pyridoxal phosphate binding / glucose homeostasis / secretory granule lumen / ficolin-1-rich granule lumen / Neutrophil degranulation / extracellular exosome / extracellular region / ATP binding / identical protein binding / cytoplasm / cytosol類似検索 - 分子機能 Glycosyl transferase, family 35 / Glycogen/starch/alpha-glucan phosphorylase / Phosphorylase pyridoxal-phosphate attachment site / Carbohydrate phosphorylase / Phosphorylase pyridoxal-phosphate attachment site. / Glycogen Phosphorylase B; / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-AVE / N-acetyl-beta-D-glucopyranosylamine / PYRIDOXAL-5'-PHOSPHATE / PHOSPHATE ION / Glycogen phosphorylase, liver form類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 2.8 Å シンクロトロン / 解像度: 2.8 Å |
|---|
 データ登録者 データ登録者 | Wendt, K.U. / Dreyer, M.K. / Anderka, O. / Klabunde, T. / Loenze, P. / Defossa, E. / Schmoll, D. |
|---|
 引用 引用 |  ジャーナル: Biochemistry / 年: 2008 ジャーナル: Biochemistry / 年: 2008
タイトル: Thermodynamic characterization of allosteric glycogen phosphorylase inhibitors.
著者: Anderka, O. / Loenze, P. / Klabunde, T. / Dreyer, M.K. / Defossa, E. / Wendt, K.U. / Schmoll, D. |
|---|
| 履歴 | | 登録 | 2008年2月29日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2008年5月27日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Non-polymer description / Version format compliance |
|---|
| 改定 1.2 | 2020年7月29日 | Group: Data collection / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_site / struct_site_gen
Item: _chem_comp.name / _entity.pdbx_description ..._chem_comp.name / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_leaving_atom_flag
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.3 | 2025年3月26日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン / 解像度: 2.8 Å
シンクロトロン / 解像度: 2.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biochemistry / 年: 2008
ジャーナル: Biochemistry / 年: 2008 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3ceh.cif.gz
3ceh.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3ceh.ent.gz
pdb3ceh.ent.gz PDB形式
PDB形式 3ceh.json.gz
3ceh.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3ceh_validation.pdf.gz
3ceh_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3ceh_full_validation.pdf.gz
3ceh_full_validation.pdf.gz 3ceh_validation.xml.gz
3ceh_validation.xml.gz 3ceh_validation.cif.gz
3ceh_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ce/3ceh
https://data.pdbj.org/pub/pdb/validation_reports/ce/3ceh ftp://data.pdbj.org/pub/pdb/validation_reports/ce/3ceh
ftp://data.pdbj.org/pub/pdb/validation_reports/ce/3ceh リンク
リンク 集合体
集合体
 要素
要素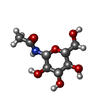

 Homo sapiens (ヒト) / 遺伝子: PYGL / 細胞株 (発現宿主): Sf9
Homo sapiens (ヒト) / 遺伝子: PYGL / 細胞株 (発現宿主): Sf9


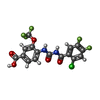






 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID14-1
/ ビームライン: ID14-1 解析
解析 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj








