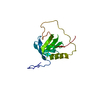
登録情報 データベース : PDB / ID : 2ys5タイトル Solution structure of the complex of the PTB domain of SNT-2 and 19-residue peptide (aa 1571-1589) of hALK ALK tyrosine kinase receptor Fibroblast growth factor receptor substrate 3 キーワード / / / / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / データ登録者 Li, H. / Koshiba, S. / Inoue, M. / Kigawa, T. / Yokoyama, S. / RIKEN Structural Genomics/Proteomics Initiative (RSGI) ジャーナル : J.Struct.Funct.Genom. / 年 : 2010タイトル: Structural basis for the recognition of nucleophosmin-anaplastic lymphoma kinase oncoprotein by the phosphotyrosine binding domain of Suc1-associated neurotrophic factor-induced ... タイトル : Structural basis for the recognition of nucleophosmin-anaplastic lymphoma kinase oncoprotein by the phosphotyrosine binding domain of Suc1-associated neurotrophic factor-induced tyrosine-phosphorylated target-2著者 : Koshiba, S. / Li, H. / Motoda, Y. / Tomizawa, T. / Kasai, T. / Tochio, N. / Yabuki, T. / Harada, T. / Watanabe, S. / Tanaka, A. / Shirouzu, M. / Kigawa, T. / Yamamoto, T. / Yokoyama, S. 履歴 登録 2007年4月3日 登録サイト / 処理サイト 改定 1.0 2008年4月8日 Provider / タイプ 改定 1.1 2011年7月13日 Group 改定 1.2 2014年2月12日 Group 改定 1.3 2024年5月1日 Group / Database referencesカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_nmr_software / pdbx_nmr_spectrometer / struct_ref_seq_dif Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_nmr_software.name / _pdbx_nmr_spectrometer.model / _struct_ref_seq_dif.details
すべて表示 表示を減らす Remark 650 HELIX Determination method: Author determined Remark 700 SHEET Determination method: Author determined
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: J.Struct.Funct.Genom. / 年: 2010
ジャーナル: J.Struct.Funct.Genom. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2ys5.cif.gz
2ys5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2ys5.ent.gz
pdb2ys5.ent.gz PDB形式
PDB形式 2ys5.json.gz
2ys5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2ys5_validation.pdf.gz
2ys5_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2ys5_full_validation.pdf.gz
2ys5_full_validation.pdf.gz 2ys5_validation.xml.gz
2ys5_validation.xml.gz 2ys5_validation.cif.gz
2ys5_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ys/2ys5
https://data.pdbj.org/pub/pdb/validation_reports/ys/2ys5 ftp://data.pdbj.org/pub/pdb/validation_reports/ys/2ys5
ftp://data.pdbj.org/pub/pdb/validation_reports/ys/2ys5 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 解説: cell-free protein synthesis / 遺伝子: FRS3 / プラスミド: P060320-18 / 参照: UniProt: O43559
Homo sapiens (ヒト) / 解説: cell-free protein synthesis / 遺伝子: FRS3 / プラスミド: P060320-18 / 参照: UniProt: O43559 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj







 NMRPipe
NMRPipe