+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2ybb | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Fitted model for bovine mitochondrial supercomplex I1III2IV1 by single particle cryo-EM (EMD-1876) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | OXIDOREDUCTASE / SUPERCOMPLEX B / MITOCHONDRIA / RESPIRATORY CHAIN / AMPHIPOL A8-35 / RANDOM CONICAL TILT | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Release of apoptotic factors from the mitochondria / Formation of apoptosome / Activation of caspases through apoptosome-mediated cleavage / Pyroptosis / Regulation of the apoptosome activity / Transcriptional activation of mitochondrial biogenesis / Detoxification of Reactive Oxygen Species / Complex III assembly / Complex IV assembly / TP53 Regulates Metabolic Genes ...Release of apoptotic factors from the mitochondria / Formation of apoptosome / Activation of caspases through apoptosome-mediated cleavage / Pyroptosis / Regulation of the apoptosome activity / Transcriptional activation of mitochondrial biogenesis / Detoxification of Reactive Oxygen Species / Complex III assembly / Complex IV assembly / TP53 Regulates Metabolic Genes / Cytoprotection by HMOX1 / respiratory chain complex IV assembly / mitochondrial respirasome assembly / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / respiratory chain complex III / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex IV / regulation of oxidative phosphorylation / Respiratory electron transport / : / : / : / oxidative phosphorylation / cytochrome-c oxidase / molybdopterin cofactor binding / quinol-cytochrome-c reductase / ubiquinol-cytochrome-c reductase activity / mitochondrial electron transport, cytochrome c to oxygen / cytochrome-c oxidase activity / mitochondrial electron transport, ubiquinol to cytochrome c / ubiquinone binding / iron-sulfur cluster assembly / Mitochondrial protein degradation / respiratory chain complex I / electron transport coupled proton transport / NADH dehydrogenase (ubiquinone) activity / ATP synthesis coupled electron transport / quinone binding / : / enzyme regulator activity / ferric iron binding / respiratory electron transport chain / central nervous system development / mitochondrial membrane / metalloendopeptidase activity / mitochondrial intermembrane space / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / mitochondrial inner membrane / electron transfer activity / oxidoreductase activity / iron ion binding / copper ion binding / heme binding / apoptotic process / mitochondrion / proteolysis / membrane / metal ion binding / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |   THERMUS THERMOPHILUS (バクテリア) THERMUS THERMOPHILUS (バクテリア)  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 19 Å | ||||||
 データ登録者 データ登録者 | Althoff, T. / Mills, D.J. / Popot, J.-L. / Kuehlbrandt, W. | ||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2011 ジャーナル: EMBO J / 年: 2011タイトル: Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. 著者: Thorsten Althoff / Deryck J Mills / Jean-Luc Popot / Werner Kühlbrandt /  要旨: The respiratory chain in the inner mitochondrial membrane contains three large multi-enzyme complexes that together establish the proton gradient for ATP synthesis, and assemble into a supercomplex. ...The respiratory chain in the inner mitochondrial membrane contains three large multi-enzyme complexes that together establish the proton gradient for ATP synthesis, and assemble into a supercomplex. A 19-Å 3D map of the 1.7-MDa amphipol-solubilized supercomplex I(1)III(2)IV(1) from bovine heart obtained by single-particle electron cryo-microscopy reveals an amphipol belt replacing the membrane lipid bilayer. A precise fit of the X-ray structures of complex I, the complex III dimer, and monomeric complex IV indicates distances of 13 nm between the ubiquinol-binding sites of complexes I and III, and of 10-11 nm between the cytochrome c binding sites of complexes III and IV. The arrangement of respiratory chain complexes suggests two possible pathways for efficient electron transfer through the supercomplex, of which the shorter branch through the complex III monomer proximal to complex I may be preferred. #1:  ジャーナル: Ph D Thesis / 年: 2011 ジャーナル: Ph D Thesis / 年: 2011タイトル: Strukturelle Untersuchungen Am Superkomplex I1III2Iv1 Der Atmungskette Mittels Kryoelektronenmikroskopie 著者: Althoff, T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2ybb.cif.gz 2ybb.cif.gz | 1.8 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2ybb.ent.gz pdb2ybb.ent.gz | 1.4 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2ybb.json.gz 2ybb.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2ybb_validation.pdf.gz 2ybb_validation.pdf.gz | 2.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2ybb_full_validation.pdf.gz 2ybb_full_validation.pdf.gz | 2.4 MB | 表示 | |
| XML形式データ |  2ybb_validation.xml.gz 2ybb_validation.xml.gz | 201.7 KB | 表示 | |
| CIF形式データ |  2ybb_validation.cif.gz 2ybb_validation.cif.gz | 342.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/yb/2ybb https://data.pdbj.org/pub/pdb/validation_reports/yb/2ybb ftp://data.pdbj.org/pub/pdb/validation_reports/yb/2ybb ftp://data.pdbj.org/pub/pdb/validation_reports/yb/2ybb | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-NADH-QUINONE OXIDOREDUCTASE SUBUNIT ... , 10種, 10分子 12345678op
| #1: タンパク質 | 分子量: 48693.715 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO1 (51KDA) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56222, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56222, NADH dehydrogenase (quinone) |
|---|---|
| #2: タンパク質 | 分子量: 20309.162 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO2 (24KDA) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56221, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56221, NADH dehydrogenase (quinone) |
| #3: タンパク質 | 分子量: 86656.203 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO3 (75KDA) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56223, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56223, NADH dehydrogenase (quinone) |
| #4: タンパク質 | 分子量: 46428.027 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO4 (49KDA) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56220, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56220, NADH dehydrogenase (quinone) |
| #5: タンパク質 | 分子量: 23893.254 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO5 (30KDA) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56219, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56219, NADH dehydrogenase (quinone) |
| #6: タンパク質 | 分子量: 20262.564 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO6 (PSST) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56218, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56218, NADH dehydrogenase (quinone) |
| #7: タンパク質 | 分子量: 14812.074 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO15 / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q5SKZ7, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q5SKZ7, NADH dehydrogenase (quinone) |
| #8: タンパク質 | 分子量: 20106.309 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: NQO9 (TYKY) / 由来: (天然)   THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56224, NADH dehydrogenase (quinone) THERMUS THERMOPHILUS (バクテリア) / 株: HB8 / 参照: UniProt: Q56224, NADH dehydrogenase (quinone) |
| #36: タンパク質 | 分子量: 32187.574 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: SUBUNIT NUON (CHAIN2) / 由来: (天然)  |
| #37: タンパク質 | 分子量: 23932.375 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: SUBUNITS NUOA, J AND K (CHAIN3,6 AND 4L) / 由来: (天然)  |
-CYTOCHROME B-C1 COMPLEX SUBUNIT ... , 9種, 18分子 AaBbEeFfGgHhIiJjKk
| #9: タンパク質 | 分子量: 49266.254 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #10: タンパク質 | 分子量: 46575.469 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #13: タンパク質 | 分子量: 21640.580 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #14: タンパク質 | 分子量: 13371.190 Da / 分子数: 2 / Mutation: YES / 由来タイプ: 天然 / 由来: (天然)  #15: タンパク質 | 分子量: 9606.027 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #16: タンパク質 | 分子量: 9189.116 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #17: タンパク質 | 分子量: 6677.736 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #18: タンパク質 | 分子量: 7209.311 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #19: タンパク質 | 分子量: 6370.390 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  |
|---|
-タンパク質 , 4種, 6分子 CcDdRY
| #11: タンパク質 | 分子量: 42620.340 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #12: タンパク質 | 分子量: 27323.277 Da / 分子数: 2 / Fragment: RESIDUES 85-325 / 由来タイプ: 天然 / 由来: (天然)  #26: タンパク質 | | 分子量: 9452.687 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  #33: タンパク質 | | 分子量: 11595.392 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|
-CYTOCHROME C OXIDASE SUBUNIT ... , 12種, 12分子 LMNOPQSTUVWX
| #20: タンパク質 | 分子量: 57065.844 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #21: タンパク質 | 分子量: 26040.393 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #22: タンパク質 | 分子量: 29957.627 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #23: タンパク質 | 分子量: 17179.646 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #24: タンパク質 | 分子量: 12453.081 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #25: タンパク質 | 分子量: 10684.038 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #27: タンパク質 | 分子量: 10039.244 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #28: タンパク質 | 分子量: 8494.982 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #29: タンパク質 | 分子量: 6682.726 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #30: タンパク質 | 分子量: 6365.217 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #31: タンパク質・ペプチド | 分子量: 5449.396 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #32: タンパク質・ペプチド | 分子量: 4967.756 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-NADH\: UBIQUINONE OXIDOREDUCTASE, MEMBRANE SUBUNIT ... , 2種, 2分子 mn
| #34: タンパク質 | 分子量: 40357.742 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: SUBUNIT NUOL (CHAIN5) / 由来: (天然)  |
|---|---|
| #35: タンパク質 | 分子量: 33293.949 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: SUBUNIT NUOM (CHAIN4) / 由来: (天然)  |
-非ポリマー , 15種, 1640分子 






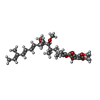
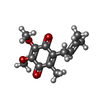


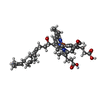

















| #38: 化合物 | ChemComp-SF4 / #39: 化合物 | ChemComp-FMN / | #40: 化合物 | ChemComp-NAI / | #41: 化合物 | ChemComp-MG / #42: 化合物 | ChemComp-FES / #43: 化合物 | ChemComp-CA / | #44: 化合物 | ChemComp-HEM / #45: 化合物 | #46: 化合物 | #47: 化合物 | #48: 化合物 | ChemComp-CDL / #49: 化合物 | #50: 化合物 | #51: 化合物 | ChemComp-ZN / | #52: 水 | ChemComp-HOH / | |
|---|
-詳細
| 配列の詳細 | DUE TO THE AMBIGUITY ABOUT THE REGISTER OF THE SEQUENCE, THESE CHAINS WERE BUILT WITH UNK RESIDUES ...DUE TO THE AMBIGUITY ABOUT THE REGISTER OF THE SEQUENCE, THESE CHAINS WERE BUILT WITH UNK RESIDUES ONLY. THE UNIPROT REFERENCES |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: RESPIRATORY SUPERCOMPLEX B (I1III2IV1) COMPOSED OF COMPLEX I, DIMERIC COMPLEX III AND COMPLEX IV FROM BOVINE HEART MITOCHONDRIA タイプ: COMPLEX 詳細: THE SUPERCOMPLEXES WERE KEPT SOLUBLE BY AMPHIPOLS A8-35 |
|---|---|
| 緩衝液 | 名称: 10 MM KCL, 15 MM HEPES, RESIDUAL TREHALOSE / pH: 7.7 / 詳細: 10 MM KCL, 15 MM HEPES, RESIDUAL TREHALOSE |
| 試料 | 濃度: 0.3 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | 詳細: CARBON |
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE 詳細: VITRIFICATION 1 -- CRYOGEN- ETHANE, HUMIDITY- 70, TEMPERATURE- 95, INSTRUMENT- CUSTOM-MADE HAND PLUNGER, METHOD- ONE- SIDED BLOTTING FOR 26 - 30 SECONDS BEFORE PLUNGING, DETAILS- SAMPLE WAS ...詳細: VITRIFICATION 1 -- CRYOGEN- ETHANE, HUMIDITY- 70, TEMPERATURE- 95, INSTRUMENT- CUSTOM-MADE HAND PLUNGER, METHOD- ONE- SIDED BLOTTING FOR 26 - 30 SECONDS BEFORE PLUNGING, DETAILS- SAMPLE WAS ADSORBED TO CARBON FILM FOR 30 SECONDS BEFORE BLOTTING |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Tecnai F30 / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI F30 詳細: LOW DOSE CONDITIONS. FOR RANDOM CONICAL TILT EACH AREA WAS IMAGED TWICE WITH THE FIRST IMAGE TAKEN AT A TILT ANGLE OF -45 OR -50 DEGREE |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 59000 X / 倍率(補正後): 58829 X / 最大 デフォーカス(公称値): 6000 nm / 最小 デフォーカス(公称値): 500 nm / Cs: 2 mm |
| 試料ホルダ | 温度: 78 K / 傾斜角・最大: 0 ° / 傾斜角・最小: -50 ° |
| 撮影 | 電子線照射量: 25 e/Å2 / フィルム・検出器のモデル: KODAK SO-163 FILM |
| 画像スキャン | デジタル画像の数: 154 |
| 放射波長 | 相対比: 1 |
- 解析
解析
| EMソフトウェア |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | 詳細: PHASE-FLIPPPING ON EACH PARTICLE | |||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | |||||||||||||||||||||
| 3次元再構成 | 手法: RANDOM CONICAL TILT AND PROJECTION MATCHING WITH DIRECT FOURIER BACKPROJECTION AND SIRT 解像度: 19 Å / 粒子像の数: 10684 / ピクセルサイズ(公称値): 4.76 Å / ピクセルサイズ(実測値): 4.76 Å 詳細: FINAL MAP WAS CALCULATED WITH SIRT FROM COMBINED TILTED AND UNTILTED DATASETS WITH 10684 PARTICLES EACH AND OMITTING 30 PER CENT OF IMAGES WITH LOWEST CROSS CORRELATION. THIS ENTRY IS BASED ...詳細: FINAL MAP WAS CALCULATED WITH SIRT FROM COMBINED TILTED AND UNTILTED DATASETS WITH 10684 PARTICLES EACH AND OMITTING 30 PER CENT OF IMAGES WITH LOWEST CROSS CORRELATION. THIS ENTRY IS BASED ON PDBS 3IAM,3M9C,1PP9,1BGY,1OCC AND 2B4Z WHICH WERE FITTED MANUALLY INTO THE EM DENSITY MAP OF BOVINE SUPERCOMPLEX I1III2IV1. THE POSITION OF 2B4Z WAS INFERRED FROM PDB 3CX5. THE CHAIN NAMES ARE CASE SENSITIVE. CHAINS A-K AND a-k DENOTE IDENTICAL CHAINS WITHIN A DIMER. CHAINS L-X AND M-P BELONG TO DIFFERENT PROTEINS. SUBMISSION BASED ON EXPERIMENTAL DATA FROM EMDB EMD-1876. 対称性のタイプ: POINT | |||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / 詳細: METHOD--RIGID BODY REFINEMENT PROTOCOL--X-RAY | |||||||||||||||||||||
| 原子モデル構築 |
| |||||||||||||||||||||
| 精密化 | 最高解像度: 19 Å | |||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 19 Å
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj








































