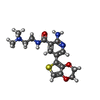
| 登録情報 | データベース: PDB / ID: 2wtj
|
|---|
| タイトル | CRYSTAL STRUCTURE OF CHK2 IN COMPLEX WITH AN INHIBITOR |
|---|
 要素 要素 | CHECKPOINT KINASE 2 |
|---|
 キーワード キーワード | TRANSFERASE / KINASE / CELL CYCLE / LI-FRAUMENI SYNDROME |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of anoikis / mitotic DNA damage checkpoint signaling / response to glycoside / cellular response to bisphenol A / regulation of autophagosome assembly / mitotic intra-S DNA damage checkpoint signaling / thymocyte apoptotic process / cellular response to stress / regulation of protein catabolic process / negative regulation of DNA damage checkpoint ...positive regulation of anoikis / mitotic DNA damage checkpoint signaling / response to glycoside / cellular response to bisphenol A / regulation of autophagosome assembly / mitotic intra-S DNA damage checkpoint signaling / thymocyte apoptotic process / cellular response to stress / regulation of protein catabolic process / negative regulation of DNA damage checkpoint / replicative senescence / signal transduction in response to DNA damage / mitotic spindle assembly / intrinsic apoptotic signaling pathway in response to DNA damage by p53 class mediator / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / DNA damage checkpoint signaling / regulation of signal transduction by p53 class mediator / Ubiquitin-Mediated Degradation of Phosphorylated Cdc25A / Stabilization of p53 / protein catabolic process / G2/M DNA damage checkpoint / cellular response to gamma radiation / PML body / Regulation of TP53 Activity through Methylation / intrinsic apoptotic signaling pathway in response to DNA damage / G2/M transition of mitotic cell cycle / Regulation of TP53 Degradation / cellular response to xenobiotic stimulus / double-strand break repair / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / protein autophosphorylation / Regulation of TP53 Activity through Phosphorylation / eukaryotic translation initiation factor 2alpha kinase activity / 3-phosphoinositide-dependent protein kinase activity / DNA-dependent protein kinase activity / ribosomal protein S6 kinase activity / histone H3S10 kinase activity / histone H2AXS139 kinase activity / histone H3S28 kinase activity / histone H4S1 kinase activity / histone H2BS14 kinase activity / histone H3T3 kinase activity / histone H2AS121 kinase activity / Rho-dependent protein serine/threonine kinase activity / histone H2BS36 kinase activity / histone H3S57 kinase activity / histone H2AT120 kinase activity / AMP-activated protein kinase activity / histone H2AS1 kinase activity / histone H3T6 kinase activity / histone H3T11 kinase activity / histone H3T45 kinase activity / non-specific serine/threonine protein kinase / protein stabilization / protein phosphorylation / cell division / protein serine kinase activity / protein serine/threonine kinase activity / ubiquitin protein ligase binding / DNA damage response / regulation of DNA-templated transcription / protein kinase binding / positive regulation of DNA-templated transcription / Golgi apparatus / protein homodimerization activity / nucleoplasm / ATP binding / metal ion binding / identical protein binding / nucleus / cytoplasm類似検索 - 分子機能 Forkhead associated domain / Forkhead-associated (FHA) domain profile. / FHA domain / Forkhead-associated (FHA) domain / SMAD/FHA domain superfamily / Phosphorylase Kinase; domain 1 / Phosphorylase Kinase; domain 1 / Transferase(Phosphotransferase) domain 1 / Transferase(Phosphotransferase); domain 1 / Serine/threonine-protein kinase, active site ...Forkhead associated domain / Forkhead-associated (FHA) domain profile. / FHA domain / Forkhead-associated (FHA) domain / SMAD/FHA domain superfamily / Phosphorylase Kinase; domain 1 / Phosphorylase Kinase; domain 1 / Transferase(Phosphotransferase) domain 1 / Transferase(Phosphotransferase); domain 1 / Serine/threonine-protein kinase, active site / Serine/Threonine protein kinases active-site signature. / Protein kinase domain / Serine/Threonine protein kinases, catalytic domain / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily / 2-Layer Sandwich / Orthogonal Bundle / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 NITRATE ION / Chem-WTJ / Serine/threonine-protein kinase Chk2 / Serine/threonine-protein kinase Chk2類似検索 - 構成要素 |
|---|
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.1 Å 分子置換 / 解像度: 2.1 Å |
|---|
 データ登録者 データ登録者 | Hilton, S. / Naud, S. / Caldwell, J.J. / Boxall, K. / Burns, S. / Anderson, V.E. / Antoni, L. / Allen, C.E. / Pearl, L.H. / Oliver, A.W. ...Hilton, S. / Naud, S. / Caldwell, J.J. / Boxall, K. / Burns, S. / Anderson, V.E. / Antoni, L. / Allen, C.E. / Pearl, L.H. / Oliver, A.W. / Aherne, G.W. / Garrett, M.D. / Collins, I. |
|---|
 引用 引用 |  ジャーナル: Bioorg.Med.Chem. / 年: 2010 ジャーナル: Bioorg.Med.Chem. / 年: 2010
タイトル: Identification and Characterisation of 2-Aminopyridine Inhibitors of Checkpoint Kinase 2
著者: Hilton, S. / Naud, S. / Caldwell, J.J. / Boxall, K. / Burns, S. / Anderson, V.E. / Antoni, L. / Allen, C.E. / Pearl, L.H. / Oliver, A.W. / Aherne, G.W. / Garrett, M.D. / Collins, I. |
|---|
| 履歴 | | 登録 | 2009年9月16日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2009年12月29日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年5月8日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2023年12月20日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.1 Å
分子置換 / 解像度: 2.1 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Bioorg.Med.Chem. / 年: 2010
ジャーナル: Bioorg.Med.Chem. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2wtj.cif.gz
2wtj.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2wtj.ent.gz
pdb2wtj.ent.gz PDB形式
PDB形式 2wtj.json.gz
2wtj.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/wt/2wtj
https://data.pdbj.org/pub/pdb/validation_reports/wt/2wtj ftp://data.pdbj.org/pub/pdb/validation_reports/wt/2wtj
ftp://data.pdbj.org/pub/pdb/validation_reports/wt/2wtj リンク
リンク 集合体
集合体
 要素
要素 HOMO SAPIENS (ヒト) / プラスミド: PTHREE-E / 発現宿主:
HOMO SAPIENS (ヒト) / プラスミド: PTHREE-E / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID14-2 / 波長: 0.933
/ ビームライン: ID14-2 / 波長: 0.933  解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー



















 PDBj
PDBj