[English] 日本語
 Yorodumi
Yorodumi- PDB-2wob: 3b' carbohydrate-binding module from the Cel9V glycoside hydrolas... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2wob | ||||||
|---|---|---|---|---|---|---|---|
| Title | 3b' carbohydrate-binding module from the Cel9V glycoside hydrolase from Clostridium thermocellum. Orthorhombic structure | ||||||
 Components Components | GLYCOSIDE HYDROLASE, FAMILY 9 | ||||||
 Keywords Keywords | HYDROLASE / CELLULOSE DEGRADATION / GLYCOSIDE HYDROLASE | ||||||
| Function / homology |  Function and homology information Function and homology informationcellulose binding / polysaccharide catabolic process / hydrolase activity, hydrolyzing O-glycosyl compounds / metal ion binding Similarity search - Function | ||||||
| Biological species |  CLOSTRIDIUM THERMOCELLUM (bacteria) CLOSTRIDIUM THERMOCELLUM (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 2 Å MOLECULAR REPLACEMENT / Resolution: 2 Å | ||||||
 Authors Authors | Petkun, S. / Jindou, S. / Shimon, L.J.W. / Bayer, E.A. / Lamed, R. / Frolow, F. | ||||||
 Citation Citation |  Journal: Acta Crystallogr.,Sect.D / Year: 2010 Journal: Acta Crystallogr.,Sect.D / Year: 2010Title: Structure of a Family 3B' Carbohydrate-Binding Module from the Cel9V Glycoside Hydrolase from Clostridium Thermocellum: Structural Diversity and Implications for Carbohydrate Binding Authors: Petkun, S. / Jindou, S. / Shimon, L.J.W. / Bayer, E.A. / Lamed, R. / Frolow, F. #1: Journal: Fems Microbiol.Lett. / Year: 2006 Title: Novel Architecture of Family-9 Glycoside Hydrolases Identified in Cellulosomal Enzymes of Acetivibrio Cellulolyticus and Clostridium Thermocellum. Authors: Jindou, S. / Xu, Q. / Kenig, R. / Shulman, M. / Shoham, Y. / Bayer, E.A. / Lamed, R. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2wob.cif.gz 2wob.cif.gz | 107.1 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2wob.ent.gz pdb2wob.ent.gz | 83.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2wob.json.gz 2wob.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/wo/2wob https://data.pdbj.org/pub/pdb/validation_reports/wo/2wob ftp://data.pdbj.org/pub/pdb/validation_reports/wo/2wob ftp://data.pdbj.org/pub/pdb/validation_reports/wo/2wob | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  2wnxC  2wo4C  2w04S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 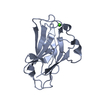
| ||||||||
| 2 | 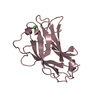
| ||||||||
| 3 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 18649.406 Da / Num. of mol.: 3 / Fragment: CARBOHYDRATE-BINDING MODULE 3B', RESIDUES 731-888 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  CLOSTRIDIUM THERMOCELLUM (bacteria) / Production host: CLOSTRIDIUM THERMOCELLUM (bacteria) / Production host:  #2: Chemical | #3: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.68 Å3/Da / Density % sol: 54.21 % / Description: NONE |
|---|---|
| Crystal grow | pH: 5.6 Details: 0.2 M AMMONIUM ACETATE, 0.1 M TRI-SODIUM CITRATE DIHYDRATE PH 5.6, 30% W/V PEG 4000 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU ULTRAX 18 / Wavelength: 1.5418 ROTATING ANODE / Type: RIGAKU ULTRAX 18 / Wavelength: 1.5418 |
| Detector | Type: RIGAKU RAXIS IV / Detector: IMAGE PLATE / Date: Mar 8, 2004 / Details: OSMIC CONFOCAL MIRRORS |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Resolution: 2→50 Å / Num. obs: 41368 / % possible obs: 95 % / Observed criterion σ(I): 0 / Redundancy: 3.5 % / Biso Wilson estimate: 31.5 Å2 / Rmerge(I) obs: 0.08 / Net I/σ(I): 16.9 |
| Reflection shell | Resolution: 2→2.03 Å / Redundancy: 2.9 % / Rmerge(I) obs: 0.49 / Mean I/σ(I) obs: 1.6 / % possible all: 89.7 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 2W04 Resolution: 2→121.18 Å / Cor.coef. Fo:Fc: 0.972 / Cor.coef. Fo:Fc free: 0.949 / SU B: 7.595 / SU ML: 0.096 / TLS residual ADP flag: LIKELY RESIDUAL / Cross valid method: THROUGHOUT / ESU R: 0.138 / ESU R Free: 0.142 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. U VALUES RESIDUAL ONLY. DISORDERED REGIONS WERE MODELED STEREOCHEMICALLY ACCORDING TO HIGHER RESOLUTION STRUCTURE 2WNX.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: BABINET MODEL WITH MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 33.402 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2→121.18 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj



