| 登録情報 | データベース: PDB / ID: 2rpn
|
|---|
| タイトル | A crucial role for high intrinsic specificity in the function of yeast SH3 domains |
|---|
 要素 要素 | - Actin-binding protein
- Actin-regulating kinase 1
|
|---|
 キーワード キーワード | STRUCTURAL PROTEIN / SH3 domain / extended peptide / 3-10 helix / Acetylation / Actin-binding / Cytoplasm / Cytoskeleton / Phosphoprotein |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
protein localization to actin cortical patch / site of polarized growth / positive regulation of Arp2/3 complex-mediated actin nucleation / actin cortical patch assembly / regulation of clathrin-dependent endocytosis / actin cortical patch / regulation of actin filament polymerization / barbed-end actin filament capping / mating projection tip / cortical actin cytoskeleton ...protein localization to actin cortical patch / site of polarized growth / positive regulation of Arp2/3 complex-mediated actin nucleation / actin cortical patch assembly / regulation of clathrin-dependent endocytosis / actin cortical patch / regulation of actin filament polymerization / barbed-end actin filament capping / mating projection tip / cortical actin cytoskeleton / actin filament organization / actin filament binding / cell cortex / non-specific serine/threonine protein kinase / protein kinase activity / protein serine kinase activity / protein serine/threonine kinase activity / ATP binding / cytoplasm類似検索 - 分子機能 Fungal actin-binding protein 1, second SH3 domain / Actin-depolymerising factor homology domain / Cofilin/tropomyosin-type actin-binding protein / ADF-H domain profile. / Actin depolymerisation factor/cofilin -like domains / ADF-H/Gelsolin-like domain superfamily / SH3 Domains / SH3 domain / Src homology 3 domains / SH3 type barrels. ...Fungal actin-binding protein 1, second SH3 domain / Actin-depolymerising factor homology domain / Cofilin/tropomyosin-type actin-binding protein / ADF-H domain profile. / Actin depolymerisation factor/cofilin -like domains / ADF-H/Gelsolin-like domain superfamily / SH3 Domains / SH3 domain / Src homology 3 domains / SH3 type barrels. / SH3-like domain superfamily / Src homology 3 (SH3) domain profile. / SH3 domain / Roll / Serine/threonine-protein kinase, active site / Serine/Threonine protein kinases active-site signature. / Protein kinase domain / Serine/Threonine protein kinases, catalytic domain / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily / Mainly Beta類似検索 - ドメイン・相同性 Actin-binding protein / Actin-regulating kinase 1類似検索 - 構成要素 |
|---|
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) |
|---|
| 手法 | 溶液NMR / simulated annealing |
|---|
| Model details | Solution structure of Abp1p SH3 doain complexed with peptide from Ark1p |
|---|
 データ登録者 データ登録者 | Stollar, E.J. / Garcia, B. / Chong, A. / Forman-Kay, J. / Davidson, A. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2009 ジャーナル: J.Biol.Chem. / 年: 2009
タイトル: Structural, functional, and bioinformatic studies demonstrate the crucial role of an extended peptide binding site for the SH3 domain of yeast Abp1p
著者: Stollar, E.J. / Garcia, B. / Chong, P.A. / Rath, A. / Lin, H. / Forman-Kay, J.D. / Davidson, A.R. |
|---|
| 履歴 | | 登録 | 2008年6月12日 | 登録サイト: BMRB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2009年6月16日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2022年3月16日 | Group: Data collection / Database references / Derived calculations
カテゴリ: database_2 / pdbx_nmr_software ...database_2 / pdbx_nmr_software / pdbx_struct_assembly / pdbx_struct_oper_list / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_nmr_software.name / _struct_ref_seq_dif.details |
|---|
| 改定 1.3 | 2024年5月29日 | Group: Data collection / カテゴリ: chem_comp_atom / chem_comp_bond |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2009
ジャーナル: J.Biol.Chem. / 年: 2009 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2rpn.cif.gz
2rpn.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2rpn.ent.gz
pdb2rpn.ent.gz PDB形式
PDB形式 2rpn.json.gz
2rpn.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2rpn_validation.pdf.gz
2rpn_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2rpn_full_validation.pdf.gz
2rpn_full_validation.pdf.gz 2rpn_validation.xml.gz
2rpn_validation.xml.gz 2rpn_validation.cif.gz
2rpn_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/rp/2rpn
https://data.pdbj.org/pub/pdb/validation_reports/rp/2rpn ftp://data.pdbj.org/pub/pdb/validation_reports/rp/2rpn
ftp://data.pdbj.org/pub/pdb/validation_reports/rp/2rpn リンク
リンク 集合体
集合体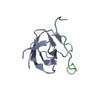
 要素
要素



 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj
 HSQC
HSQC