| 登録情報 | データベース: PDB / ID: 2pq3
|
|---|
| タイトル | N-Terminal Calmodulin Zn-Trapped Intermediate |
|---|
 要素 要素 | Calmodulin |
|---|
 キーワード キーワード | METAL BINDING PROTEIN / CALMODULIN / HELIX-TURN-HELIX / EF-HAND / N-TERMINAL CALMODULIN / CAM / N-CAM |
|---|
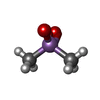
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
regulation of store-operated calcium channel activity / : / regulation of high voltage-gated calcium channel activity / regulation of response to tumor cell / positive regulation of autophagic cell death / DAPK1-calmodulin complex / : / : / positive regulation of cyclic-nucleotide phosphodiesterase activity / : ...regulation of store-operated calcium channel activity / : / regulation of high voltage-gated calcium channel activity / regulation of response to tumor cell / positive regulation of autophagic cell death / DAPK1-calmodulin complex / : / : / positive regulation of cyclic-nucleotide phosphodiesterase activity / : / establishment of protein localization to mitochondrial membrane / type 3 metabotropic glutamate receptor binding / establishment of protein localization to membrane / positive regulation of DNA binding / negative regulation of high voltage-gated calcium channel activity / nitric-oxide synthase binding / negative regulation of calcium ion export across plasma membrane / organelle localization by membrane tethering / mitochondrion-endoplasmic reticulum membrane tethering / autophagosome membrane docking / regulation of synaptic vesicle exocytosis / presynaptic endocytosis / regulation of cardiac muscle cell action potential / positive regulation of ryanodine-sensitive calcium-release channel activity / negative regulation of ryanodine-sensitive calcium-release channel activity / calcineurin-mediated signaling / regulation of synaptic vesicle endocytosis / protein phosphatase activator activity / postsynaptic cytosol / regulation of ryanodine-sensitive calcium-release channel activity / adenylate cyclase binding / catalytic complex / detection of calcium ion / regulation of cardiac muscle contraction / phosphatidylinositol 3-kinase binding / presynaptic cytosol / calcium channel inhibitor activity / cellular response to interferon-beta / activation of adenylate cyclase activity / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / enzyme regulator activity / regulation of calcium-mediated signaling / titin binding / voltage-gated potassium channel complex / calcium channel regulator activity / potassium ion transmembrane transport / sperm midpiece / calcium channel complex / calyx of Held / nitric-oxide synthase regulator activity / response to amphetamine / positive regulation of nitric-oxide synthase activity / adenylate cyclase activator activity / regulation of heart rate / protein serine/threonine kinase activator activity / sarcomere / regulation of cytokinesis / positive regulation of receptor signaling pathway via JAK-STAT / spindle microtubule / calcium-mediated signaling / Schaffer collateral - CA1 synapse / cellular response to type II interferon / response to calcium ion / spindle pole / calcium-dependent protein binding / G2/M transition of mitotic cell cycle / disordered domain specific binding / myelin sheath / growth cone / protein autophosphorylation / vesicle / transmembrane transporter binding / neuron projection / positive regulation of apoptotic process / protein domain specific binding / centrosome / calcium ion binding / protein kinase binding / protein-containing complex / mitochondrion / nucleoplasm / nucleus / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 EF-hand / : / Recoverin; domain 1 / EF-hand domain pair / EF-hand, calcium binding motif / EF-Hand 1, calcium-binding site / EF-hand calcium-binding domain. / EF-hand calcium-binding domain profile. / EF-hand domain / EF-hand domain pair ...EF-hand / : / Recoverin; domain 1 / EF-hand domain pair / EF-hand, calcium binding motif / EF-Hand 1, calcium-binding site / EF-hand calcium-binding domain. / EF-hand calcium-binding domain profile. / EF-hand domain / EF-hand domain pair / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 CACODYLATE ION / Calmodulin-1 / Calmodulin-1類似検索 - 構成要素 |
|---|
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 1.3 Å 単波長異常分散 / 解像度: 1.3 Å |
|---|
 データ登録者 データ登録者 | Warren, J.T. / Guo, Q. / Tang, W.J. |
|---|
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2007 ジャーナル: J.Mol.Biol. / 年: 2007
タイトル: A 1.3-A structure of zinc-bound N-terminal domain of calmodulin elucidates potential early ion-binding step.
著者: Warren, J.T. / Guo, Q. / Tang, W.J. |
|---|
| 履歴 | | 登録 | 2007年5月1日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2007年10月16日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Derived calculations / Version format compliance |
|---|
| 改定 1.2 | 2024年2月21日 | Group: Data collection / Database references / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  単波長異常分散 / 解像度: 1.3 Å
単波長異常分散 / 解像度: 1.3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Mol.Biol. / 年: 2007
ジャーナル: J.Mol.Biol. / 年: 2007 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2pq3.cif.gz
2pq3.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2pq3.ent.gz
pdb2pq3.ent.gz PDB形式
PDB形式 2pq3.json.gz
2pq3.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/pq/2pq3
https://data.pdbj.org/pub/pdb/validation_reports/pq/2pq3 ftp://data.pdbj.org/pub/pdb/validation_reports/pq/2pq3
ftp://data.pdbj.org/pub/pdb/validation_reports/pq/2pq3 リンク
リンク 集合体
集合体

 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 19-ID / 波長: 0.9792911
/ ビームライン: 19-ID / 波長: 0.9792911  単波長異常分散
単波長異常分散 解析
解析 単波長異常分散 / 解像度: 1.3→32 Å / Num. parameters: 7049 / Num. restraintsaints: 9042 / 交差検証法: FREE R / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber
単波長異常分散 / 解像度: 1.3→32 Å / Num. parameters: 7049 / Num. restraintsaints: 9042 / 交差検証法: FREE R / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj