+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2n8i | ||||||
|---|---|---|---|---|---|---|---|
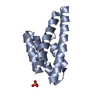
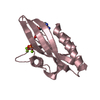
| タイトル | Solution NMR Structure of Designed Protein DA05, Northeast Structural Genomics Consortium (NESG) Target OR626 | ||||||
 要素 要素 | Designed Protein DA05 | ||||||
 キーワード キーワード | DE NOVO PROTEIN / designed protein / PSI-Biology / Northeast Structural Genomics Consortium / NESG | ||||||
| 生物種 | synthetic construct (人工物) | ||||||
| 手法 | 溶液NMR / simulated annealing | ||||||
| Model details | lowest energy, model1 | ||||||
 データ登録者 データ登録者 | Xu, X. / Eletsky, A. / Federizon, J.F. / Jacobs, T.M. / Kuhlman, B. / Szyperski, T. / Northeast Structural Genomics Consortium (NESG) | ||||||
 引用 引用 |  ジャーナル: Science / 年: 2016 ジャーナル: Science / 年: 2016タイトル: Design of structurally distinct proteins using strategies inspired by evolution. 著者: Jacobs, T.M. / Williams, B. / Williams, T. / Xu, X. / Eletsky, A. / Federizon, J.F. / Szyperski, T. / Kuhlman, B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2n8i.cif.gz 2n8i.cif.gz | 701 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2n8i.ent.gz pdb2n8i.ent.gz | 596 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2n8i.json.gz 2n8i.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2n8i_validation.pdf.gz 2n8i_validation.pdf.gz | 531.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2n8i_full_validation.pdf.gz 2n8i_full_validation.pdf.gz | 690.4 KB | 表示 | |
| XML形式データ |  2n8i_validation.xml.gz 2n8i_validation.xml.gz | 41.7 KB | 表示 | |
| CIF形式データ |  2n8i_validation.cif.gz 2n8i_validation.cif.gz | 62.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/n8/2n8i https://data.pdbj.org/pub/pdb/validation_reports/n8/2n8i ftp://data.pdbj.org/pub/pdb/validation_reports/n8/2n8i ftp://data.pdbj.org/pub/pdb/validation_reports/n8/2n8i | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 11148.562 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現) synthetic construct (人工物) / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 試料状態 | pH: 6.5 / 圧: ambient / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Varian INOVA / 製造業者: Varian / モデル: INOVA / 磁場強度: 750 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: simulated annealing / ソフトェア番号: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR constraints | NOE constraints total: 1506 / NOE intraresidue total count: 452 / NOE long range total count: 330 / NOE medium range total count: 396 / NOE sequential total count: 328 / Protein chi angle constraints total count: 0 / Protein other angle constraints total count: 0 / Protein phi angle constraints total count: 77 / Protein psi angle constraints total count: 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 代表構造 | 選択基準: lowest energy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: target function / 計算したコンフォーマーの数: 100 / 登録したコンフォーマーの数: 20 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj

 HSQC
HSQC