+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2fud | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human Cathepsin S with Inhibitor CRA-27566 | ||||||
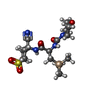
 要素 要素 | cathepsin S | ||||||
 キーワード キーワード | HYDROLASE / cysteine protease / proteinase / papain / 27566 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cathepsin S / regulation of antigen processing and presentation / basement membrane disassembly / positive regulation of cation channel activity / antigen processing and presentation of peptide antigen / endolysosome lumen / response to acidic pH / cellular response to thyroid hormone stimulus / Trafficking and processing of endosomal TLR / proteoglycan binding ...cathepsin S / regulation of antigen processing and presentation / basement membrane disassembly / positive regulation of cation channel activity / antigen processing and presentation of peptide antigen / endolysosome lumen / response to acidic pH / cellular response to thyroid hormone stimulus / Trafficking and processing of endosomal TLR / proteoglycan binding / Assembly of collagen fibrils and other multimeric structures / toll-like receptor signaling pathway / antigen processing and presentation / collagen catabolic process / fibronectin binding / extracellular matrix disassembly / collagen binding / laminin binding / phagocytic vesicle / Degradation of the extracellular matrix / MHC class II antigen presentation / cysteine-type peptidase activity / lysosomal lumen / proteolysis involved in protein catabolic process / Endosomal/Vacuolar pathway / antigen processing and presentation of exogenous peptide antigen via MHC class II / protein processing / tertiary granule lumen / late endosome / : / ficolin-1-rich granule lumen / adaptive immune response / lysosome / immune response / serine-type endopeptidase activity / cysteine-type endopeptidase activity / intracellular membrane-bounded organelle / Neutrophil degranulation / proteolysis / extracellular space / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.95 Å 分子置換 / 解像度: 1.95 Å | ||||||
 データ登録者 データ登録者 | Somoza, J.R. | ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Human Cathepsin S with Inhibitor CRA-27566 著者: Somoza, J.R. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2fud.cif.gz 2fud.cif.gz | 103.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2fud.ent.gz pdb2fud.ent.gz | 79.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2fud.json.gz 2fud.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2fud_validation.pdf.gz 2fud_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2fud_full_validation.pdf.gz 2fud_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  2fud_validation.xml.gz 2fud_validation.xml.gz | 24.5 KB | 表示 | |
| CIF形式データ |  2fud_validation.cif.gz 2fud_validation.cif.gz | 33.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fu/2fud https://data.pdbj.org/pub/pdb/validation_reports/fu/2fud ftp://data.pdbj.org/pub/pdb/validation_reports/fu/2fud ftp://data.pdbj.org/pub/pdb/validation_reports/fu/2fud | HTTPS FTP |
-関連構造データ
| 類似構造データ |
|---|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | The biological unit is probably the monomer, or one half of the asymmetric unit. |
- 要素
要素
| #1: タンパク質 | 分子量: 25006.027 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) Homo sapiens (ヒト)発現宿主:  参照: UniProt: P25774, cathepsin S #2: 化合物 | #3: 水 | ChemComp-HOH / | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.77 Å3/Da / 溶媒含有率: 55.61 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法 / pH: 5 詳細: 22.5%-30% PEG 8K, 0.1 M sodium citrate (pH 5.0), 0.2 M ammonium sulfate, VAPOR DIFFUSION, temperature 293.0K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.54 Å 回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.54 Å |
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.54 Å / 相対比: 1 |
| 反射 | 解像度: 1.73→38.82 Å / Num. obs: 51744 / % possible obs: 87.1 % / 冗長度: 7.78 % / Χ2: 1.12 / Net I/σ(I): 5.3 / Scaling rejects: 3046 |
| 反射 シェル | 解像度: 1.73→1.79 Å / % possible all: 29.8 |
-位相決定
| Phasing MR | Rfactor: 0.494 / Cor.coef. Fo:Fc: 0.39
|
|---|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 1.95→38.82 Å / FOM work R set: 0.895 / σ(F): 0 / 立体化学のターゲット値: Engh & Huber 分子置換 / 解像度: 1.95→38.82 Å / FOM work R set: 0.895 / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 17.913 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.95→38.82 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 50
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj