| 登録情報 | データベース: PDB / ID: 2f3l
|
|---|
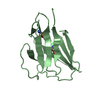
| タイトル | Crystal Structure of a Lumenal Rfr-domain protein (Contig83.1_1_243_746) from Cyanothece sp. 51142 at 2.1 Angstrom resolution. |
|---|
 要素 要素 | RFR-Domain |
|---|
 キーワード キーワード | UNKNOWN FUNCTION / Beta Helix |
|---|
| 機能・相同性 | Thylakoid lumenal 15kDa protein 1-like / plasma membrane-derived thylakoid lumen / Pentapeptide repeats (8 copies) / Pentapeptide repeat / E3 ubiquitin-protein ligase SopA / Pectate Lyase C-like / 3 Solenoid / Mainly Beta / Pentapeptide repeat protein Rfr32 機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |  Cyanothece sp. ATCC 51142 (バクテリア) Cyanothece sp. ATCC 51142 (バクテリア) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 2.11 Å 単波長異常分散 / 解像度: 2.11 Å |
|---|
 データ登録者 データ登録者 | Kennedy, M.A. / Ni, S. / Buchko, G.W. / Robinson, H. |
|---|
 引用 引用 |  ジャーナル: Protein Sci. / 年: 2006 ジャーナル: Protein Sci. / 年: 2006
タイトル: Characterization of two potentially universal turn motifs that shape the repeated five-residues fold-Crystal structure of a lumenal pentapeptide repeat protein from Cyanothece 51142.
著者: Buchko, G.W. / Ni, S. / Robinson, H. / Welsh, E.A. / Pakrasi, H.B. / Kennedy, M.A. |
|---|
| 履歴 | | 登録 | 2005年11月21日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2006年11月7日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年5月1日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2024年11月13日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_leaving_atom_flag |
|---|
|
|---|
| Remark 999 | SEQUENCE NO SUITABLE SEQUENCE DATABASE REFERENCE WAS AVAILABLE AT THE TIME OF PROCESSING THIS FILE. |
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Cyanothece sp. ATCC 51142 (バクテリア)
Cyanothece sp. ATCC 51142 (バクテリア) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  単波長異常分散 / 解像度: 2.11 Å
単波長異常分散 / 解像度: 2.11 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Protein Sci. / 年: 2006
ジャーナル: Protein Sci. / 年: 2006 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2f3l.cif.gz
2f3l.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2f3l.ent.gz
pdb2f3l.ent.gz PDB形式
PDB形式 2f3l.json.gz
2f3l.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2f3l_validation.pdf.gz
2f3l_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2f3l_full_validation.pdf.gz
2f3l_full_validation.pdf.gz 2f3l_validation.xml.gz
2f3l_validation.xml.gz 2f3l_validation.cif.gz
2f3l_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/f3/2f3l
https://data.pdbj.org/pub/pdb/validation_reports/f3/2f3l ftp://data.pdbj.org/pub/pdb/validation_reports/f3/2f3l
ftp://data.pdbj.org/pub/pdb/validation_reports/f3/2f3l リンク
リンク 集合体
集合体
 要素
要素 Cyanothece sp. ATCC 51142 (バクテリア)
Cyanothece sp. ATCC 51142 (バクテリア)
 X線回折 / 使用した結晶の数: 2
X線回折 / 使用した結晶の数: 2  試料調製
試料調製 解析
解析 単波長異常分散 / 解像度: 2.11→50 Å / 交差検証法: random / σ(F): 2 / σ(I): 2 / 立体化学のターゲット値: Engh & Huber
単波長異常分散 / 解像度: 2.11→50 Å / 交差検証法: random / σ(F): 2 / σ(I): 2 / 立体化学のターゲット値: Engh & Huber ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj

