+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2a4q | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | HCV NS3 protease with NS4a peptide and a covalently bound macrocyclic ketoamide compound. | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | VIRAL PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報self proteolysis / symbiont-mediated transformation of host cell / host cell membrane / viral process / serine-type peptidase activity / virion component / host cell / symbiont entry into host cell / virion attachment to host cell / virion membrane ...self proteolysis / symbiont-mediated transformation of host cell / host cell membrane / viral process / serine-type peptidase activity / virion component / host cell / symbiont entry into host cell / virion attachment to host cell / virion membrane / metal ion binding / membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  Hepatitis C virus (ウイルス) Hepatitis C virus (ウイルス) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 2.45 Å フーリエ合成 / 解像度: 2.45 Å | ||||||
 データ登録者 データ登録者 | Chen, K.X. / Njoroge, F.G. / Prongay, A. / Pichardo, J. / Madison, V. / Girijavallabhan, V. | ||||||
 引用 引用 |  ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2005 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2005タイトル: Synthesis and Biological Activity of Macrocyclic Inhibitors of Hepatitis C Virus (HCV) NS3 Protease 著者: Chen, K.X. / Njoroge, F.G. / Prongay, A. / Pichardo, J. / Madison, V. / Girijavallabhan, V. #1:  ジャーナル: Cell(Cambridge,Mass.) / 年: 1996 ジャーナル: Cell(Cambridge,Mass.) / 年: 1996タイトル: Crystal Structure of the Hepatitis C Virus NS3 Protease Domain Complexed with a Synthetic NS4a Cofactor Peptide 著者: Kim, J.L. / Morgenstern, K.A. / Lin, C. / Fox, T. / Dwyer, M.D. / Landro, J.A. / Chambers, S.P. / Markland, W. / Lepre, C.A. / O'Malley, E.T. / Harbeson, S.L. / Rice, C.M. / Murcko, M.A. / ...著者: Kim, J.L. / Morgenstern, K.A. / Lin, C. / Fox, T. / Dwyer, M.D. / Landro, J.A. / Chambers, S.P. / Markland, W. / Lepre, C.A. / O'Malley, E.T. / Harbeson, S.L. / Rice, C.M. / Murcko, M.A. / Caron, P.R. / Thomson, J.A. #2:  ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2005 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2005タイトル: Hepatitis C virus NS3-4A serine protease inhibitors. SAR of P2' moiety with improved potency. 著者: Arasappan, A. / Njoroge, F.G. / Chan, T.Y. / Bennett, F. / Bogen, S.L. / Chen, K. / Gu, H. / Hong, L. / Jao, E. / Liu, Y.T. / Lovey, R.G. / Parekh, T. / Pike, R.E. / Pinto, P. / Santhanam, B. ...著者: Arasappan, A. / Njoroge, F.G. / Chan, T.Y. / Bennett, F. / Bogen, S.L. / Chen, K. / Gu, H. / Hong, L. / Jao, E. / Liu, Y.T. / Lovey, R.G. / Parekh, T. / Pike, R.E. / Pinto, P. / Santhanam, B. / Venkatraman, S. / Vaccaro, H. / Wang, H. / Yang, X. / Zhu, Z. / Mckittrick, B. / Saksena, A.K. / Girijavallabhan, V. / Pichardo, J. / Butkiewicz, N. / Ingram, R. / Malcolm, B. / Prongay, A.J. / Yao, N. / Marten, B. / Madison, V. / Kemp, S. / Levy, O. / Lim-Wilby, M. / Tamura, S. / Ganguly, A.K. #3:  ジャーナル: Cell(Cambridge,Mass.) / 年: 1996 ジャーナル: Cell(Cambridge,Mass.) / 年: 1996タイトル: The Crystal Structure of Hepatitis C Virus NS3 proteinase Reveals a Trypsin-like fold and a Structural Zinc Binding Site. 著者: Love, R.A. / Parge, H.E. / Wickersham, J.A. / Hostomsky, Z. / Habuka, N. / Moomaw, E.W. / Adachi, T. / Hostomska, Z. #4:  ジャーナル: Protein Sci. / 年: 1998 ジャーナル: Protein Sci. / 年: 1998タイトル: Complex of NS3 protease and NS4a peptide of BK strain hepatitis C virus: A 2.2A resolution structure in a hexagonal crystal form. 著者: Yan, Y. / Li, Y. / Munshi, S. / Sardana, V. / Cole, L.J. / Sardana, M. / Steinkuehler, C. / Tomei, L. / De Francesco, R. / Kuo, L.C. / Chen, Z. #5:  ジャーナル: J.Biol.Chem. / 年: 2000 ジャーナル: J.Biol.Chem. / 年: 2000タイトル: Inhibition of the Hepatitis C Virus NS3/4A Protease. The Crystal Structures of Two protease-inhibitor complexes. 著者: DiMarco, S. / Rizzi, M. / Volpari, C. / Walsh, M.A. / Narjes, F. / Colarusso, S. / De Francesco, R. / Matassa, V.G. / Sollazzo, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2a4q.cif.gz 2a4q.cif.gz | 85.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2a4q.ent.gz pdb2a4q.ent.gz | 68.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2a4q.json.gz 2a4q.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2a4q_validation.pdf.gz 2a4q_validation.pdf.gz | 777.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2a4q_full_validation.pdf.gz 2a4q_full_validation.pdf.gz | 786.1 KB | 表示 | |
| XML形式データ |  2a4q_validation.xml.gz 2a4q_validation.xml.gz | 18.9 KB | 表示 | |
| CIF形式データ |  2a4q_validation.cif.gz 2a4q_validation.cif.gz | 26.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/a4/2a4q https://data.pdbj.org/pub/pdb/validation_reports/a4/2a4q ftp://data.pdbj.org/pub/pdb/validation_reports/a4/2a4q ftp://data.pdbj.org/pub/pdb/validation_reports/a4/2a4q | HTTPS FTP |
-関連構造データ
| 関連構造データ | |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | Dimer (Chains A and C) of the protease domain with a NS4a peptide bound (Chains B and D). Only Chain A has the covalent adducts with the inhibitor SCH383913 and 2-mercaptoethanol. |
- 要素
要素
-タンパク質 / タンパク質・ペプチド , 2種, 4分子 ACBD
| #1: タンパク質 | 分子量: 21233.225 Da / 分子数: 2 / 断片: protease domain, residues 1-181 / 由来タイプ: 組換発現 / 由来: (組換発現)  Hepatitis C virus (ウイルス) / 属: Hepacivirus / 発現宿主: Hepatitis C virus (ウイルス) / 属: Hepacivirus / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 2394.039 Da / 分子数: 2 / 断片: residues 21-39 / 由来タイプ: 合成 詳細: THE PEPTIDE WAS CHEMICALLY SYNTHESIZED. THE SEQUENCE OF THE PROTEIN IS NATURALLY FOUND IN HEPATITIS C VIRUS TYPE 1B. 参照: UniProt: O39914 |
|---|
-非ポリマー , 4種, 173分子 

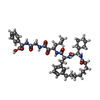




| #3: 化合物 | | #4: 化合物 | ChemComp-BME / | #5: 化合物 | ChemComp-FNH / ( | #6: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.88 Å3/Da / 溶媒含有率: 68.28 % |
|---|---|
| 結晶化 | 温度: 285 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.7 詳細: MES, sodium potassium phosphate, sodium chloride, 2-mercaptoethanol, pH 5.7, VAPOR DIFFUSION, HANGING DROP, temperature 285K |
-データ収集
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 17-ID / 波長: 1 Å / ビームライン: 17-ID / 波長: 1 Å |
|---|---|
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2004年11月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 2.45→50 Å / Num. obs: 26060 / % possible obs: 98.63 % / Observed criterion σ(I): 1.7 / 冗長度: 3.8 % / Rmerge(I) obs: 0.071 / Net I/σ(I): 15.36 |
| 反射 シェル | 解像度: 2.45→2.51 Å / Rmerge(I) obs: 0.466 / Mean I/σ(I) obs: 1.72 / Num. unique all: 1580 / % possible all: 89.2 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 / 解像度: 2.45→8 Å / 立体化学のターゲット値: Engh & Huber フーリエ合成 / 解像度: 2.45→8 Å / 立体化学のターゲット値: Engh & Huber
| |||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.45→8 Å
| |||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.45→2.51 Å
|
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj





