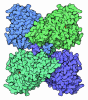
| 登録情報 | データベース: PDB / ID: 1zzt
|
|---|
| タイトル | Bovine eNOS N368D/V106M double mutant with L-N(omega)-Nitroarginine-(4R)-Amino-L-Proline Amide Bound |
|---|
 要素 要素 | Nitric-oxide synthase, endothelial |
|---|
 キーワード キーワード | OXIDOREDUCTASE / enzyme-inhibtor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
cellular response to laminar fluid shear stress / positive regulation of guanylate cyclase activity / negative regulation of leukocyte cell-cell adhesion / nitric oxide mediated signal transduction / nitric-oxide synthase (NADPH) / nitric-oxide synthase activity / L-arginine catabolic process / negative regulation of extrinsic apoptotic signaling pathway via death domain receptors / negative regulation of blood pressure / response to hormone ...cellular response to laminar fluid shear stress / positive regulation of guanylate cyclase activity / negative regulation of leukocyte cell-cell adhesion / nitric oxide mediated signal transduction / nitric-oxide synthase (NADPH) / nitric-oxide synthase activity / L-arginine catabolic process / negative regulation of extrinsic apoptotic signaling pathway via death domain receptors / negative regulation of blood pressure / response to hormone / nitric oxide biosynthetic process / mitochondrion organization / caveola / blood coagulation / FMN binding / flavin adenine dinucleotide binding / NADP binding / response to lipopolysaccharide / cytoskeleton / calmodulin binding / heme binding / Golgi apparatus / metal ion binding / nucleus / plasma membrane / cytosol類似検索 - 分子機能 Bovine Endothelial Nitric Oxide Synthase Heme Domain; Chain: A,domain 3 / Nitric Oxide Synthase; Chain A, domain 3 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase;Heme Domain; Chain A, domain 2 / Nitric Oxide Synthase;Heme Domain;Chain A domain 2 / Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily ...Bovine Endothelial Nitric Oxide Synthase Heme Domain; Chain: A,domain 3 / Nitric Oxide Synthase; Chain A, domain 3 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase;Heme Domain; Chain A, domain 2 / Nitric Oxide Synthase;Heme Domain;Chain A domain 2 / Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily / Nitric oxide synthase, domain 1 superfamily / Nitric oxide synthase, domain 3 superfamily / : / Nitric oxide synthase, oxygenase domain / Nitric oxide synthase (NOS) signature. / Sulfite reductase [NADPH] flavoprotein alpha-component-like, FAD-binding / NADPH-cytochrome p450 reductase, FAD-binding, alpha-helical domain superfamily / FAD binding domain / Flavodoxin-like / Flavoprotein pyridine nucleotide cytochrome reductase / Flavodoxin / Flavodoxin-like domain profile. / Flavodoxin/nitric oxide synthase / Oxidoreductase FAD/NAD(P)-binding / Oxidoreductase NAD-binding domain / FAD-binding domain, ferredoxin reductase-type / Ferredoxin-NADP reductase (FNR), nucleotide-binding domain / Ferredoxin reductase-type FAD binding domain profile. / Riboflavin synthase-like beta-barrel / Flavoprotein-like superfamily / Alpha-Beta Complex / Alpha Beta類似検索 - ドメイン・相同性 ACETATE ION / Chem-DP9 / 5,6,7,8-TETRAHYDROBIOPTERIN / PROTOPORPHYRIN IX CONTAINING FE / Nitric oxide synthase 3類似検索 - 構成要素 |
|---|
| 生物種 |   Bos taurus (ウシ) Bos taurus (ウシ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 2.14 Å シンクロトロン / 解像度: 2.14 Å |
|---|
 データ登録者 データ登録者 | Li, H. / Flinspach, M.L. / Igarashi, J. / Jamal, J. / Yang, W. / Gomez-Vidal, J.A. / Litzinger, E.A. / Silverman, R.B. / Poulos, T.L. |
|---|
 引用 引用 |  ジャーナル: Biochemistry / 年: 2005タイトル ジャーナル: Biochemistry / 年: 2005タイトル: Exploring the Binding Conformations of Bulkier Dipeptide Amide Inhibitors in Constitutive Nitric Oxide Synthases. 著者: Li, H. / Flinspach, M.L. / Igarashi, J. / Jamal, J. / Yang, W. / Litzinger, E.A. / Huang, H. / Erdal, E.P. / Silverman, R.B. / Poulos, T.L.#1:  ジャーナル: Nat.Struct.Mol.Biol. / 年: 2004タイトル ジャーナル: Nat.Struct.Mol.Biol. / 年: 2004タイトル: Structural Basis for Dipeptide Amide Isoform-Selective Inhibition of Neuronal Nitric Oxide Synthase 著者: Flinspach, M.L. / Li, H. / Jamal, J. / Yang, W. / Huang, H. / Hah, J.M. / Gomez-Vidal, J.A. / Litzinger, E.A. / Silverman, R.B. / Poulos, T.L. |
|---|
| 履歴 | | 登録 | 2005年6月14日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2005年12月6日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月30日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2021年10月20日 | Group: Database references / Derived calculations
カテゴリ: database_2 / pdbx_struct_conn_angle ...database_2 / pdbx_struct_conn_angle / struct_conn / struct_conn_type / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_conn_type.id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2023年12月20日 | Group: Data collection / カテゴリ: chem_comp_atom / chem_comp_bond |
|---|
| 改定 1.5 | 2024年11月13日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン / 解像度: 2.14 Å
シンクロトロン / 解像度: 2.14 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biochemistry / 年: 2005
ジャーナル: Biochemistry / 年: 2005 ジャーナル: Nat.Struct.Mol.Biol. / 年: 2004
ジャーナル: Nat.Struct.Mol.Biol. / 年: 2004 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1zzt.cif.gz
1zzt.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1zzt.ent.gz
pdb1zzt.ent.gz PDB形式
PDB形式 1zzt.json.gz
1zzt.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/zz/1zzt
https://data.pdbj.org/pub/pdb/validation_reports/zz/1zzt ftp://data.pdbj.org/pub/pdb/validation_reports/zz/1zzt
ftp://data.pdbj.org/pub/pdb/validation_reports/zz/1zzt リンク
リンク 集合体
集合体
 要素
要素




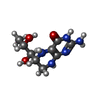
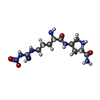






 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ALS
ALS  / ビームライン: 5.0.1 / 波長: 1 Å
/ ビームライン: 5.0.1 / 波長: 1 Å 解析
解析 ムービー
ムービー コントローラー
コントローラー




























 PDBj
PDBj