+ データを開く
データを開く
- 基本情報
基本情報
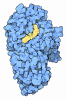
| 登録情報 | データベース: PDB / ID: 1xid | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | MODES OF BINDING SUBSTRATES AND THEIR ANALOGUES TO THE ENZYME D-XYLOSE ISOMERASE | |||||||||
 要素 要素 | D-XYLOSE ISOMERASE | |||||||||
 キーワード キーワード | ISOMERASE(INTRAMOLECULAR OXIDOREDUCTASE) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報xylose isomerase / xylose isomerase activity / D-xylose metabolic process / magnesium ion binding / identical protein binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Streptomyces rubiginosus (バクテリア) Streptomyces rubiginosus (バクテリア) | |||||||||
| 手法 |  X線回折 / 解像度: 1.7 Å X線回折 / 解像度: 1.7 Å | |||||||||
 データ登録者 データ登録者 | Carrell, H.L. / Glusker, J.P. | |||||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.D / 年: 1994 ジャーナル: Acta Crystallogr.,Sect.D / 年: 1994タイトル: Modes of binding substrates and their analogues to the enzyme D-xylose isomerase. 著者: Carrell, H.L. / Hoier, H. / Glusker, J.P. #1:  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 1989 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 1989タイトル: X-Ray Analysis of D-Xylose Isomerase at 1.9 Angstroms: Native Enzyme in Complex with Substrate and with a Mechanism-Designed Inactivator 著者: Carrell, H.L. / Glusker, J.P. / Burger, V. / Manfre, F. / Biellmann, D.Tritsch J.-F. #2:  ジャーナル: Protein Eng. / 年: 1987 ジャーナル: Protein Eng. / 年: 1987タイトル: Comparison of Backbone Structures of Glucose Isomerase from Streptomyces and Arthrobacter 著者: Henrick, K. / Blow, D.M. / Carrell, H.L. / Glusker, J.P. #3:  ジャーナル: J.Biol.Chem. / 年: 1984 ジャーナル: J.Biol.Chem. / 年: 1984タイトル: X-Ray Crystal Structure of D-Xylose Isomerase at 4-Angstroms Resolution 著者: Carrell, H.L. / Rubin, B.H. / Hurley, T.J. / Glusker, J.P. | |||||||||
| 履歴 |
| |||||||||
| Remark 700 | SHEET THE STRUCTURE OF THE MONOMER IS AN EIGHT-FOLD ALPHA-BETA BARREL WITH AN EXTENDED C-TERMINAL ...SHEET THE STRUCTURE OF THE MONOMER IS AN EIGHT-FOLD ALPHA-BETA BARREL WITH AN EXTENDED C-TERMINAL LOOP WHICH FACILITATES AGGREGATION OF MONOMERS TO TETRAMERS. TETRAMERS ARE POSITIONED ON THE 222 SYMMETRY SITE AT THE ORIGIN OF THE CELL. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1xid.cif.gz 1xid.cif.gz | 95.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1xid.ent.gz pdb1xid.ent.gz | 72 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1xid.json.gz 1xid.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1xid_validation.pdf.gz 1xid_validation.pdf.gz | 391.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1xid_full_validation.pdf.gz 1xid_full_validation.pdf.gz | 405.6 KB | 表示 | |
| XML形式データ |  1xid_validation.xml.gz 1xid_validation.xml.gz | 10.9 KB | 表示 | |
| CIF形式データ |  1xid_validation.cif.gz 1xid_validation.cif.gz | 17.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/xi/1xid https://data.pdbj.org/pub/pdb/validation_reports/xi/1xid ftp://data.pdbj.org/pub/pdb/validation_reports/xi/1xid ftp://data.pdbj.org/pub/pdb/validation_reports/xi/1xid | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||
| 単位格子 |
| |||||||||
| Atom site foot note | 1: ASN 2 - TYR 3 OMEGA =213.28 PEPTIDE BOND DEVIATES SIGNIFICANTLY FROM TRANS CONFORMATION 2: CIS PROLINE - PRO 187 | |||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 43254.234 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  Streptomyces rubiginosus (バクテリア) Streptomyces rubiginosus (バクテリア)参照: UniProt: P24300, xylose isomerase | ||||
|---|---|---|---|---|---|
| #2: 化合物 | | #3: 糖 | ChemComp-ASC / | #4: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.78 Å3/Da / 溶媒含有率: 55.81 % |
|---|
- 解析
解析
| ソフトウェア | 名称: PROLSQ / 分類: 精密化 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.7→10 Å / σ(I): 2 /
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.7→10 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






















 PDBj
PDBj