+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1w9r | ||||||
|---|---|---|---|---|---|---|---|
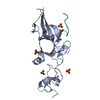
| タイトル | Solution Structure of Choline Binding Protein A, Domain R2, the Major Adhesin of Streptococcus pneumoniae | ||||||
 要素 要素 | CHOLINE BINDING PROTEIN A | ||||||
 キーワード キーワード | RECEPTOR / CBPA / POLYMERIC IMMUNOGLOBULIN RECEPTOR / PIGR / ADHESION / INVASION / PATHOGENESIS | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |  | ||||||
| 手法 | 溶液NMR / TAD | ||||||
 データ登録者 データ登録者 | Luo, R. / Mann, B. / Lewis, W.S. / Rowe, A. / Heath, R. / Stewart, M.L. / Hamburger, A.E. / Bjorkman, P.J. / Sivakolundu, S. / Lacy, E.R. ...Luo, R. / Mann, B. / Lewis, W.S. / Rowe, A. / Heath, R. / Stewart, M.L. / Hamburger, A.E. / Bjorkman, P.J. / Sivakolundu, S. / Lacy, E.R. / Tuomanen, E. / Kriwacki, R.W. | ||||||
 引用 引用 |  ジャーナル: Embo J. / 年: 2005 ジャーナル: Embo J. / 年: 2005タイトル: Solution Structure of Choline Binding Protein A, the Major Adhesin of Streptococcus Pneumoniae 著者: Luo, R. / Mann, B. / Lewis, W.S. / Rowe, A. / Heath, R. / Stewart, M.L. / Hamburger, A.E. / Sivakolundu, S. / Lacy, E.R. / Bjorkman, P.J. / Tuomanen, E. / Kriwacki, R.W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1w9r.cif.gz 1w9r.cif.gz | 725.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1w9r.ent.gz pdb1w9r.ent.gz | 610.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1w9r.json.gz 1w9r.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1w9r_validation.pdf.gz 1w9r_validation.pdf.gz | 355.7 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1w9r_full_validation.pdf.gz 1w9r_full_validation.pdf.gz | 500.4 KB | 表示 | |
| XML形式データ |  1w9r_validation.xml.gz 1w9r_validation.xml.gz | 38.5 KB | 表示 | |
| CIF形式データ |  1w9r_validation.cif.gz 1w9r_validation.cif.gz | 63.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/w9/1w9r https://data.pdbj.org/pub/pdb/validation_reports/w9/1w9r ftp://data.pdbj.org/pub/pdb/validation_reports/w9/1w9r ftp://data.pdbj.org/pub/pdb/validation_reports/w9/1w9r | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 13826.608 Da / 分子数: 1 / 断片: ADHESION DOMAIN RESIDUES 329-443 / 由来タイプ: 組換発現 詳細: THE FIRST FOUR RESIDUES (N-TER-GSHM) DERIVE FROM THE PET28A EXPRESSION VECTOR. THE FOLLOWING RESIDUES CORRESPOND TO RESIDUES 329-443 OF CBPA FROM THE TIGR4 STRAIN OF S. PNEUMONIAE. 由来: (組換発現)  株: TIGR4 / プラスミド: PET28A / 発現宿主:  |
|---|---|
| 配列の詳細 | THE PRIMARY ACCESSION NUMBER CORRESPONDS TO THE CBPA PROTEIN SEQUENCE. THIS IS DERIVED FROM THE ...THE PRIMARY ACCESSION NUMBER CORRESPOND |
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR実験の詳細 | Text: CBPA-R2 STRUCTURES WERE CALCULATED USING NMR DATA COLLECTED AT 25 C. INTERPROTON DISTANCES WERE ESTIMATED FROM THE VOLUMES OF CROSS-PEAKS IN 3D AND 4D NOESY SPECTRA. THE RESTRAINT LOWER BOUNDS ...Text: CBPA-R2 STRUCTURES WERE CALCULATED USING NMR DATA COLLECTED AT 25 C. INTERPROTON DISTANCES WERE ESTIMATED FROM THE VOLUMES OF CROSS-PEAKS IN 3D AND 4D NOESY SPECTRA. THE RESTRAINT LOWER BOUNDS WERE SET TO THE VAN DER WAALS DISTANCE, AND UPPER BOUNDS WERE SET TO 2.5, 3.5, AND 6.0 FOR STRONG, MEDIUM, AND WEAK RESONANCES, RESPECTIVELY. ESTIMATES OF BACKBONE DIHEDRAL ANGLES F AND Y WERE OBTAINED USING THE PROGRAM TALOS AND 1H , 15N, 13C , 13C , AND 13CO CHEMICAL SHIFT VALUES. TALOS-BASED AND RESTRAINTS WERE USED ONLY WHEN A WELL-DEFINED PREDICTION WAS OBTAINED, AND THIS OCCURRED WITHIN THE HELICAL SEGMENTS OF CBPA-R2. IN ADDITION, H-BOND RESTRAINTS WERE USED WITHIN -HELICES IN THE FOLLOWING WAY. TWO DISTANCE RESTRAINTS WERE USED FOR EACH HYDROGEN BOND, ONE BETWEEN THE HYDROGEN AND THE ACCEPTOR ATOM 1.5-2.3 AND ONE BETWEEN THE DONOR HEAVY ATOM AND THE ACCEPTOR ATOM 2.4-3.3. THESE WERE INTRODUCED AFTER THE INITIAL SET OF STRUCTURE CALCULATIONS. AMIDE PROTONS INVOLVED IN H-BONDS WERE IDENTIFIED ON THE BASIS OF SLOW EXCHANGE WITH D2O. A TOTAL OF 2292 NOE INTERPROTON DISTANCE RESTRAINTS, 83 PAIRS OF AND BACKBONE DIHEDRAL ANGLE RESTRAINTS, AND 146 PAIRS OF H-BOND RESTRAINTS WERE USED TO CALCULATE AN ENSEMBLE OF STRUCTURES USING A MODIFIED VERSION OF THE ORIGINAL TORSION ANGLE DYNAMICS PROTOCOL ROUTINE WITHIN CNS. THE TAD PROTOCOL WAS AS FOLLOWS 75 PS HIGH-TEMPERATURE TAD 50 000 K FOLLOWED BY COOLING TO 1000 K OVER THE COURSE OF 75 PS AND RAMPING OF THE VAN DER WAALS SCALING TERM FROM 0.1 TO 1.0. THE MOLECULES WERE FURTHER COOLED TO 300 K OVER THE COURSE OF 20 PS USING CONVENTIONAL CARTESIAN DYNAMICS FOLLOWED FINALLY BY 10000 STEPS OF CONJUGATE GRADIENT ENERGY MINIMIZATION. THE NOE ENERGY TERM WAS 150 FOR THE FIRST THREE STEPS AND 100 FOR THE LAST. THE DIHEDRAL RESTRAINT TERM WAS 100 FOR THE FIRST THREE STEPS AND 300 FOR THE LAST. TWO HUNDRED STRUCTURES WERE CALCULATED, AND THE LOWEST 40 STRUCTURES WERE FURTHER REFINED BY USING THE SANDER MODULE OF AMBER 8.0 MOLECULAR MODELING SUITE. |
- 試料調製
試料調製
| 詳細 | 内容: 10 MM POTASSIUM PHOSPHATE BUFFER, PH 6.5, 50 MM NACL, 0.02 % (W/V) SODIUM AZIDE, AND 95% H2O/5 % 2H2O (V/V) |
|---|---|
| 試料状態 | イオン強度: APPROX. 60 MM / pH: 6.5 / 圧: 1.0 atm / 温度: 298.0 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Varian INOVA / 製造業者: Varian / モデル: INOVA / 磁場強度: 600 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: TAD / ソフトェア番号: 1 詳細: A TOTAL OF 2292 NOE INTERPROTON DISTANCE RESTRAINTS, 83 PAIRS OF PSI AND PHI AND BACKBONE DIHEDRAL ANGLE RESTRAINTS, AND 146 PAIRS OF H-BOND RESTRAINTS WERE USED TO CALCULATE AN ENSEMBLE OF ...詳細: A TOTAL OF 2292 NOE INTERPROTON DISTANCE RESTRAINTS, 83 PAIRS OF PSI AND PHI AND BACKBONE DIHEDRAL ANGLE RESTRAINTS, AND 146 PAIRS OF H-BOND RESTRAINTS WERE USED TO CALCULATE AN ENSEMBLE OF STRUCTURES USING A MODIFIED VERSION OF THE ORIGINAL TORSION ANGLE DYNAMICS PROTOCOL ROUTINE WITHIN CNS. THE TAD PROTOCOL WAS AS FOLLOWS. 75 PS HIGH-TEMPERATURE TAD 50000 K FOLLOWED BY COOLING TO 1000 K OVER THE COURSE OF 75 PS AND RAMPING OF THE VAN DER WAALS SCALING TERM FROM 0.1 TO 1.0. THE MOLECULES WERE FURTHER COOLED TO 300 K OVER THE COURSE OF 20 PS USING CONVENTIONAL CARTESIAN DYNAMICS FOLLOWED FINALLY BY 10000 STEPS OF CONJUGATE GRADIENT ENERGY MINIMIZATION. THE NOE ENERGY TERM WAS 150 KCAL PER MOL FOR THE FIRST THREE STEPS AND 100 KCAL PER MOL FOR THE LAST. THE DIHEDRAL RESTRAINT TERM WAS 100 KCAL PER MOL FOR THE FIRST THREE STEPS AND 300 KCAL PER MOL FOR THE LAST. TWO HUNDRED STRUCTURES WERE CALCULATED, AND THE LOWEST 40 STRUCTURES WERE FURTHER REFINED BY USING THE SANDER MODULE OF AMBER 8.0 MOLECULAR MODELING SUITE. THE SOLVENT WAS REPRESENTED BY GENERALIZED-BORN GB SOLVENT MODEL. THE STRUCTURES WERE FIRST ENERGY MINIMIZED FOR1 PS WITHOUT ANY RESTRAINTS FOLLOWED BY 40 PS SIMULATED ANNEALING FROM 400 K TO 0 K WITH ALL THE RESTRAINTS. THE DISTANCE AND ANGLE RESTRAINTS WERE REPRESENTED BY A SQUARE-WELL PENALTY FUNCTION WITH FORCE CONSTANTS OF 20 KCAL PER MOL AND 2 KCAL PER MOL, RESPECTIVELY. | ||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: LEAST ENERGY / 計算したコンフォーマーの数: 200 / 登録したコンフォーマーの数: 19 |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj
 HNCA
HNCA