+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1urm | ||||||
|---|---|---|---|---|---|---|---|
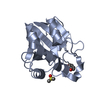
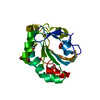
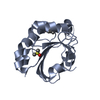
| タイトル | HUMAN PEROXIREDOXIN 5, C47S MUTANT | ||||||
 要素 要素 | PEROXIREDOXIN 5 | ||||||
 キーワード キーワード | ANTIOXIDANT ENZYME / PEROXIREDOXIN / THIOREDOXIN PEROXIDASE / THIOREDOXIN FOLD | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報peroxynitrite reductase activity / reactive nitrogen species metabolic process / negative regulation of oxidoreductase activity / negative regulation of transcription by RNA polymerase III / regulation of apoptosis involved in tissue homeostasis / RNA polymerase III transcription regulatory region sequence-specific DNA binding / thioredoxin-dependent peroxiredoxin / thioredoxin peroxidase activity / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / Detoxification of Reactive Oxygen Species ...peroxynitrite reductase activity / reactive nitrogen species metabolic process / negative regulation of oxidoreductase activity / negative regulation of transcription by RNA polymerase III / regulation of apoptosis involved in tissue homeostasis / RNA polymerase III transcription regulatory region sequence-specific DNA binding / thioredoxin-dependent peroxiredoxin / thioredoxin peroxidase activity / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / Detoxification of Reactive Oxygen Species / antioxidant activity / peroxisomal matrix / positive regulation of collagen biosynthetic process / cell redox homeostasis / cellular response to reactive oxygen species / hydrogen peroxide catabolic process / TP53 Regulates Metabolic Genes / peroxidase activity / peroxisome / cellular response to oxidative stress / response to oxidative stress / cytoplasmic vesicle / mitochondrial matrix / inflammatory response / signaling receptor binding / intracellular membrane-bounded organelle / negative regulation of apoptotic process / perinuclear region of cytoplasm / mitochondrion / extracellular space / extracellular exosome / identical protein binding / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.7 Å 分子置換 / 解像度: 1.7 Å | ||||||
 データ登録者 データ登録者 | Declercq, J.P. / Evrard, C. | ||||||
 引用 引用 |  ジャーナル: J. Chem. Cryst. / 年: 2004 ジャーナル: J. Chem. Cryst. / 年: 2004タイトル: Crystal Structure of the C47S Mutant of Human Peroxiredoxin 5 著者: Evrard, C. / Smeets, A. / Knoops, B. / Declercq, J.P. #1:  ジャーナル: J.Mol.Biol. / 年: 2001 ジャーナル: J.Mol.Biol. / 年: 2001タイトル: Crystal Structure of Human Peroxiredoxin 5, a Novel Type of Mammalian Peroxiredoxin at 1.5 A Resolution 著者: Declercq, J.P. / Evrard, C. / Clippe, A. / Vanderstricht, D. / Bernard, A. / Knoops, B. #2: ジャーナル: Acta Crystallogr.,Sect.D / 年: 2001 タイトル: A Twinned Monoclinic Crystal Form of Human Peroxiredoxin 5 with Eight Molecules in the Asymmetric Unit 著者: Declercq, J.P. / Evrard, C. #3: ジャーナル: J.Biol.Chem. / 年: 1999 タイトル: Cloning and Characterization of Aoeb166, a Novel Mammalian Antioxidant Enzyme of the Peroxiredoxin Family 著者: Knoops, B. / Clippe, A. / Bogard, C. / Arsalane, K. / Wattiez, R. / Hermans, C. / Duconseille, E. / Falmagne, P. / Bernard, A. | ||||||
| 履歴 |
| ||||||
| Remark 650 | HELIX DETERMINATION METHOD: AUTHOR PROVIDED. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1urm.cif.gz 1urm.cif.gz | 53.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1urm.ent.gz pdb1urm.ent.gz | 37.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1urm.json.gz 1urm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1urm_validation.pdf.gz 1urm_validation.pdf.gz | 435.9 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1urm_full_validation.pdf.gz 1urm_full_validation.pdf.gz | 435.9 KB | 表示 | |
| XML形式データ |  1urm_validation.xml.gz 1urm_validation.xml.gz | 11.8 KB | 表示 | |
| CIF形式データ |  1urm_validation.cif.gz 1urm_validation.cif.gz | 17.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ur/1urm https://data.pdbj.org/pub/pdb/validation_reports/ur/1urm ftp://data.pdbj.org/pub/pdb/validation_reports/ur/1urm ftp://data.pdbj.org/pub/pdb/validation_reports/ur/1urm | HTTPS FTP |
-関連構造データ
| 関連構造データ |  1hd2S S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 18177.785 Da / 分子数: 1 / 断片: RESIDUES 54-214 / 変異: YES / 由来タイプ: 組換発現 / 詳細: MUTATION CYS 47 SER IN COORDINATES / 由来: (組換発現)  HOMO SAPIENS (ヒト) / 器官: LUNG / プラスミド: PQE-30 / 発現宿主: HOMO SAPIENS (ヒト) / 器官: LUNG / プラスミド: PQE-30 / 発現宿主:  | ||||||
|---|---|---|---|---|---|---|---|
| #2: 化合物 | ChemComp-BEZ / | ||||||
| #3: 化合物 | | #4: 水 | ChemComp-HOH / | 構成要素の詳細 | ENGINEERED MUTATION CYS 100 SER (FOLLOWING NUMBERING OF THE SWISSPROT DATABASE REFERENCE). FUNCTION ...ENGINEERED | 配列の詳細 | C47S MUTANT | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.4 Å3/Da / 溶媒含有率: 63.5 % |
|---|---|
| 結晶化 | pH: 5.3 詳細: PROTEIN WAS CRYSTALLIZED FROM 1.6 M AMMONIUM SULFATE, 0.1 M SODIUM CITRATE BUFFER PH 5.3, 0.2 M POTASSIUM SODIUM TARTRATE, 1 MM DTT, 0.02 % (W/V) SODIUM AZIDE |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  EMBL/DESY, HAMBURG EMBL/DESY, HAMBURG  / ビームライン: BW7A / 波長: 0.9911 / ビームライン: BW7A / 波長: 0.9911 |
| 検出器 | タイプ: MARRESEARCH / 検出器: CCD / 日付: 2001年11月12日 / 詳細: BENT MIRROR |
| 放射 | モノクロメーター: DOUBLE CRYSTAL FOCUSING MONOCHROMATOR プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9911 Å / 相対比: 1 |
| 反射 | 解像度: 1.7→37 Å / Num. obs: 30149 / % possible obs: 99.8 % / 冗長度: 6.1 % / Rmerge(I) obs: 0.053 / Net I/σ(I): 32 |
| 反射 シェル | 解像度: 1.7→1.74 Å / 冗長度: 5.5 % / Rmerge(I) obs: 0.292 / Mean I/σ(I) obs: 5.5 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1HD2 解像度: 1.7→40 Å / Cor.coef. Fo:Fc: 0.974 / Cor.coef. Fo:Fc free: 0.967 / SU B: 1.189 / SU ML: 0.04 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / ESU R: 0.067 / ESU R Free: 0.068 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: BABINET MODEL WITH MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 15.15 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.7→40 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj