+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1qzw | ||||||
|---|---|---|---|---|---|---|---|
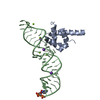
| タイトル | Crystal structure of the complete core of archaeal SRP and implications for inter-domain communication | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | Signaling Protein/RNA / Signal recognition particle / SRP / ribonucleoprotein complex / protein-RNA complex / protein targeting / Signaling Protein-RNA COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報signal recognition particle / signal-recognition-particle GTPase / 7S RNA binding / SRP-dependent cotranslational protein targeting to membrane / GTPase activity / GTP binding / ATP hydrolysis activity 類似検索 - 分子機能 | ||||||
| 生物種 |   Sulfolobus solfataricus (古細菌) Sulfolobus solfataricus (古細菌) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 4.1 Å 分子置換 / 解像度: 4.1 Å | ||||||
 データ登録者 データ登録者 | Rosendal, K.R. / Wild, K. / Montoya, G. / Sinning, I. | ||||||
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003タイトル: Crystal structure of the complete core of archaeal signal recognition particle and implications for interdomain communication 著者: Rosendal, K.R. / Wild, K. / Montoya, G. / Sinning, I. | ||||||
| 履歴 |
| ||||||
| Remark 650 | HELIX DETERMINED METHOD: Authors determined | ||||||
| Remark 700 | SHEET DETERMINED METHOD: Authors determined |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1qzw.cif.gz 1qzw.cif.gz | 388.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1qzw.ent.gz pdb1qzw.ent.gz | 301.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1qzw.json.gz 1qzw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1qzw_validation.pdf.gz 1qzw_validation.pdf.gz | 521.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1qzw_full_validation.pdf.gz 1qzw_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  1qzw_validation.xml.gz 1qzw_validation.xml.gz | 130.8 KB | 表示 | |
| CIF形式データ |  1qzw_validation.cif.gz 1qzw_validation.cif.gz | 179.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qz/1qzw https://data.pdbj.org/pub/pdb/validation_reports/qz/1qzw ftp://data.pdbj.org/pub/pdb/validation_reports/qz/1qzw ftp://data.pdbj.org/pub/pdb/validation_reports/qz/1qzw | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||||
| 2 | 
| ||||||||||||||||||||
| 3 | 
| ||||||||||||||||||||
| 4 | 
| ||||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
| #1: RNA鎖 | 分子量: 15555.170 Da / 分子数: 4 / 断片: SRP RNA helix 8 / 由来タイプ: 組換発現 / 由来: (組換発現)   Sulfolobus solfataricus (古細菌) / 解説: in vitro translation / 遺伝子: 7S RNA / プラスミド: pUC18 Sulfolobus solfataricus (古細菌) / 解説: in vitro translation / 遺伝子: 7S RNA / プラスミド: pUC18#2: タンパク質 | 分子量: 49463.430 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Sulfolobus solfataricus (古細菌) / 遺伝子: SRP54 / プラスミド: pET24d / 発現宿主: Sulfolobus solfataricus (古細菌) / 遺伝子: SRP54 / プラスミド: pET24d / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 6.49 Å3/Da / 溶媒含有率: 81.04 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 291 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 4.5 詳細: Ammonium sulphate, sodium chloride, sodium acetate, pH 4.5, VAPOR DIFFUSION, HANGING DROP, temperature 291K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法, ハンギングドロップ法詳細: Rosendal, K.R., (2004) Acta Crystallogr.,Sect.D, 60, 140. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID29 / 波長: 0.9763 Å / ビームライン: ID29 / 波長: 0.9763 Å |
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2003年4月14日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9763 Å / 相対比: 1 |
| 反射 | 解像度: 4.1→30 Å / Num. obs: 50447 / % possible obs: 98.1 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 1.9 % / Rsym value: 0.087 / Net I/σ(I): 4 |
| 反射 シェル | 解像度: 4.1→4.32 Å / 冗長度: 1.9 % / Mean I/σ(I) obs: 1.5 / Num. unique all: 7462 / Rsym value: 0.481 / % possible all: 99.4 |
| 反射 | *PLUS Num. obs: 49660 / % possible obs: 97.2 % / Rmerge(I) obs: 0.087 |
| 反射 シェル | *PLUS 最低解像度: 4.31 Å / % possible obs: 98.1 % / Rmerge(I) obs: 0.481 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ID 1J8M 解像度: 4.1→30 Å / Rfactor Rfree error: 0.005 / Data cutoff high absF: 1576917.54 / Data cutoff high rms absF: 1576917.54 / Data cutoff low absF: 0 / Isotropic thermal model: OVERALL / 交差検証法: THROUGHOUT / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber 詳細: The structure factor data associated with this file is from twinned crystal. To use structure factor data, this data will have to be detwinned.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 52.4117 Å2 / ksol: 0.105512 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 69.4 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 4.1→30 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 4.1 Å / 最低解像度: 30 Å / % reflection Rfree: 9 % / Rfactor Rfree: 0.387 / Rfactor Rwork: 0.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj





























