+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1qje | ||||||
|---|---|---|---|---|---|---|---|
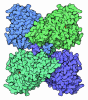
| タイトル | Isopenicillin N synthase from Aspergillus nidulans (IP1 - Fe complex) | ||||||
 要素 要素 | ISOPENICILLIN ... | ||||||
 キーワード キーワード | B-LACTAM ANTIBIOTIC / OXYGENASE / PENICILLIN BIOSYNTHESIS / ENZYME-PRODUCT COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報isopenicillin-N synthase / isopenicillin-N synthase activity / penicillin biosynthetic process / L-ascorbic acid binding / iron ion binding / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.35 Å 分子置換 / 解像度: 1.35 Å | ||||||
 データ登録者 データ登録者 | Burzlaff, N.I. / Clifton, I.J. / Rutledge, P.J. / Roach, P.L. / Adlington, R.M. / Baldwin, J.E. | ||||||
 引用 引用 |  ジャーナル: Nature / 年: 1999 ジャーナル: Nature / 年: 1999タイトル: The Reaction Cycle of Isopenicillin N Synthase Observed by X-Ray Diffraction 著者: Burzlaff, N.I. / Rutledge, P.J. / Clifton, I.J. / Hensgens, C.M.H. / Pickford, M. / Adlington, R.M. / Roach, P.L. / Baldwin, J.E. #1:  ジャーナル: Nature / 年: 1997 ジャーナル: Nature / 年: 1997タイトル: Structure of Isopenicillin N Synthase Complexed with Substrate and the Mechanism of Penicillin Formation 著者: Roach, P.L. / Clifton, I.J. / Hensgens, C.M. / Shibata, N. / Schofield, C.J. / Hajdu, J. / Baldwin, J.E. #2:  ジャーナル: Nature / 年: 1995 ジャーナル: Nature / 年: 1995タイトル: Crystal Structure of Isopenicillin N Synthase is the First from a New Structural Family of Enzymes 著者: Roach, P.L. / Clifton, I.J. / Fulop, V. / Harlos, K. / Barton, G.J. / Hajdu, J. / Andersson, I. / Schofield, C.J. / Baldwin, J.E. #3: ジャーナル: Protein Sci. / 年: 1995 タイトル: Crystallization and Preliminary X-Ray Diffraction Studies on Recombinant Isopenicillin N Synthase from Aspergillus Nidulans 著者: Roach, P.L. / Schofield, C.J. / Baldwin, J.E. / Clifton, I.J. / Hajdu, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1qje.cif.gz 1qje.cif.gz | 94.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1qje.ent.gz pdb1qje.ent.gz | 70 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1qje.json.gz 1qje.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1qje_validation.pdf.gz 1qje_validation.pdf.gz | 936.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1qje_full_validation.pdf.gz 1qje_full_validation.pdf.gz | 946.1 KB | 表示 | |
| XML形式データ |  1qje_validation.xml.gz 1qje_validation.xml.gz | 10.9 KB | 表示 | |
| CIF形式データ |  1qje_validation.cif.gz 1qje_validation.cif.gz | 18 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qj/1qje https://data.pdbj.org/pub/pdb/validation_reports/qj/1qje ftp://data.pdbj.org/pub/pdb/validation_reports/qj/1qje ftp://data.pdbj.org/pub/pdb/validation_reports/qj/1qje | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | BIOLOGICAL_UNIT: MONOMER |
- 要素
要素
-ISOPENICILLIN ... , 1種, 1分子 A
| #1: タンパク質 | 分子量: 37563.836 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: PCB C / プラスミド: PJB703 / 発現宿主:  |
|---|
-非ポリマー , 5種, 496分子 






| #2: 化合物 | ChemComp-SO4 / |
|---|---|
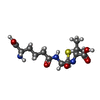
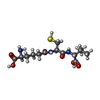
| #3: 化合物 | ChemComp-IP1 / |
| #4: 化合物 | ChemComp-ACV / |
| #5: 化合物 | ChemComp-FE2 / |
| #6: 水 | ChemComp-HOH / |
-詳細
| 構成要素の詳細 | IN THIS COMPLEX THE MOLECULES OF ISOPENICILLIN N (IP1) AND L-A-(D-AMINOADIPOYL)-L-CYSTEINYL-D- ...IN THIS COMPLEX THE MOLECULES OF ISOPENICIL |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.226 Å3/Da / 溶媒含有率: 37 % | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 8.5 詳細: 1.8M LITHIUM SULPHATE, 100MM TRIS/HCL (PH8.5), (5MM FERROUS SULPHATE, 70 MM ACMC, 50MG/ML IPNS), pH 8.50 | |||||||||||||||
| 結晶化 | *PLUS 温度: 17 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  EMBL/DESY, HAMBURG EMBL/DESY, HAMBURG  / ビームライン: BW7B / 波長: 0.8345 / ビームライン: BW7B / 波長: 0.8345 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1998年6月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.8345 Å / 相対比: 1 |
| 反射 | 解像度: 1.35→25 Å / Num. obs: 69285 / % possible obs: 92.2 % / 冗長度: 2.4 % / Rmerge(I) obs: 0.0078 / Net I/σ(I): 8.4 |
| 反射 シェル | 解像度: 1.35→1.37 Å / Rmerge(I) obs: 0.29 / Mean I/σ(I) obs: 1.8 / % possible all: 43 |
| 反射 | *PLUS Num. measured all: 404650 / Rmerge(I) obs: 0.078 |
| 反射 シェル | *PLUS % possible obs: 43 % / Num. unique obs: 1595 / Num. measured obs: 9310 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1BK0 解像度: 1.35→25 Å / Num. restraintsaints: 34969 / 交差検証法: THROUGHOUT / σ(F): 0
| |||||||||||||||||||||||||||||||||
| Refine analyze | Num. disordered residues: 3 / Occupancy sum hydrogen: 2516.4 / Occupancy sum non hydrogen: 3131.5 | |||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.35→25 Å
| |||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj