[English] 日本語
 Yorodumi
Yorodumi- PDB-1p01: Serine protease mechanism. structure of an inhibitory complex oF ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1p01 | ||||||
|---|---|---|---|---|---|---|---|
| Title | Serine protease mechanism. structure of an inhibitory complex oF ALPHA-LYTIC Protease and a tightly bound peptide boronic acid | ||||||
 Components Components | ALPHA-LYTIC PROTEASE | ||||||
 Keywords Keywords | HYDROLASE/HYDROLASE INHIBITOR / HYDROLASE-HYDROLASE INHIBITOR complex | ||||||
| Function / homology |  Function and homology information Function and homology informationalpha-lytic endopeptidase / serine-type endopeptidase activity / proteolysis / extracellular region Similarity search - Function | ||||||
| Biological species |  Lysobacter enzymogenes (bacteria) Lysobacter enzymogenes (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / Resolution: 2 Å X-RAY DIFFRACTION / Resolution: 2 Å | ||||||
 Authors Authors | Bone, R. / Agard, D.A. | ||||||
 Citation Citation |  Journal: Biochemistry / Year: 1987 Journal: Biochemistry / Year: 1987Title: Serine protease mechanism: structure of an inhibitory complex of alpha-lytic protease and a tightly bound peptide boronic acid. Authors: Bone, R. / Shenvi, A.B. / Kettner, C.A. / Agard, D.A. #1:  Journal: To be Published Journal: To be PublishedTitle: Structure Analysis of Specificity. Alpha-Lytic Protease Complexes with Analogs of Reaction Intermediates Authors: Bone, R. / Frank, D. / Kettner, C. / Agard, D.A. #2:  Journal: To be Published Journal: To be PublishedTitle: Structural Plasticity as a Determinant of Enzyme Specificity. Creating Broadly Specific Proteases Authors: Bone, R. / Silen, J.L. / Agard, D.A. #3:  Journal: Biochemistry / Year: 1988 Journal: Biochemistry / Year: 1988Title: Kinetic Properties of the Binding of Alpha-Lytic Protease to Peptide Boronic Acids Authors: Kettner, C.A. / Bone, R. / Agard, D.A. / Bachovchin, W.W. #4:  Journal: J.Mol.Biol. / Year: 1985 Journal: J.Mol.Biol. / Year: 1985Title: Refined Structure of Alpha-Lytic Protease at 1.7 Angstroms Resolution. Analysis of Hydrogen Bonding and Solvent Structure Authors: Fujinaga, M. / Delbaere, L.T.J. / Brayer, G.D. / James, M.N.G. #5:  Journal: J.Mol.Biol. / Year: 1979 Journal: J.Mol.Biol. / Year: 1979Title: Molecular Structure of the Alpha-Lytic Protease from Myxobacter 495 at 2.8 Angstroms Resolution Authors: Brayer, G.D. / Delbaere, L.T.J. / James, M.N.G. | ||||||
| History |
|
- Structure visualization
Structure visualization
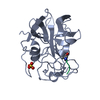
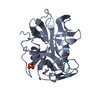
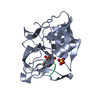
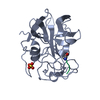
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1p01.cif.gz 1p01.cif.gz | 52.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1p01.ent.gz pdb1p01.ent.gz | 36.8 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1p01.json.gz 1p01.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/p0/1p01 https://data.pdbj.org/pub/pdb/validation_reports/p0/1p01 ftp://data.pdbj.org/pub/pdb/validation_reports/p0/1p01 ftp://data.pdbj.org/pub/pdb/validation_reports/p0/1p01 | HTTPS FTP |
|---|
-Related structure data
| Similar structure data |
|---|
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Atom site foot note | 1: RESIDUE 99A IS A CIS PROLINE. |
- Components
Components
| #1: Protein | Mass: 19875.131 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Lysobacter enzymogenes (bacteria) / Gene: alpha-LP / References: UniProt: P00778, alpha-lytic endopeptidase Lysobacter enzymogenes (bacteria) / Gene: alpha-LP / References: UniProt: P00778, alpha-lytic endopeptidase |
|---|---|
| #2: Chemical | ChemComp-0EG / |
| #3: Chemical | ChemComp-SO4 / |
| #4: Water | ChemComp-HOH / |
| Has protein modification | Y |
| Nonpolymer details | INHIBITORY PEPTIDE BORONIC ACIDS ARE PEPTIDE ANALOGUES IN WHICH THE C-TERMINAL CARBOXY GROUP (COOH) ...INHIBITORY |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION X-RAY DIFFRACTION |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.52 Å3/Da / Density % sol: 51.18 % | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | *PLUS Method: microdialysis / Details: Brayer, G.D., (1979) J.Mol.Biol., 131, 743. | ||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Radiation | Scattering type: x-ray |
|---|---|
| Radiation wavelength | Relative weight: 1 |
- Processing
Processing
| Software | Name: PROLSQ / Classification: refinement | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Rfactor obs: 0.138 / Highest resolution: 2 Å | ||||||||||||
| Refinement step | Cycle: LAST / Highest resolution: 2 Å
| ||||||||||||
| Refine LS restraints | *PLUS Type: p_bond_d / Dev ideal: 0.018 |
 Movie
Movie Controller
Controller













 PDBj
PDBj




