+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1os1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Phosphoenolpyruvate Carboxykinase complexed with ATP,Mg, Ca and pyruvate. | |||||||||
 要素 要素 | Phosphoenolpyruvate carboxykinase [ATP] | |||||||||
 キーワード キーワード | LYASE / enzyme mechanism / phosphotransfer / calcium / activation | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報phosphoenolpyruvate carboxykinase (ATP) / phosphoenolpyruvate carboxykinase (ATP) activity / gluconeogenesis / calcium ion binding / magnesium ion binding / ATP binding / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | |||||||||
 データ登録者 データ登録者 | Sudom, A. / Walters, R. / Pastushok, L. / Goldie, D. / Prasad, L. / Delbaere, L.T. / Goldie, H. | |||||||||
 引用 引用 |  ジャーナル: J.BACTERIOL. / 年: 2003 ジャーナル: J.BACTERIOL. / 年: 2003タイトル: Mechanisms of activation of phosphoenolpyruvate carboxykinase from Escherichia coli by Ca2+ and of desensitization by trypsin. 著者: Sudom, A. / Walters, R. / Pastushok, L. / Goldie, D. / Prasad, L. / Delbaere, L.T. / Goldie, H. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1os1.cif.gz 1os1.cif.gz | 124 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1os1.ent.gz pdb1os1.ent.gz | 93.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1os1.json.gz 1os1.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/os/1os1 https://data.pdbj.org/pub/pdb/validation_reports/os/1os1 ftp://data.pdbj.org/pub/pdb/validation_reports/os/1os1 ftp://data.pdbj.org/pub/pdb/validation_reports/os/1os1 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  1aqlS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 59709.176 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  参照: UniProt: P22259, phosphoenolpyruvate carboxykinase (ATP) |
|---|
-非ポリマー , 5種, 264分子 


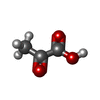





| #2: 化合物 | ChemComp-MG / |
|---|---|
| #3: 化合物 | ChemComp-CA / |
| #4: 化合物 | ChemComp-ATP / |
| #5: 化合物 | ChemComp-PYR / |
| #6: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.26 Å3/Da / 溶媒含有率: 45.12 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 294 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 4.8 詳細: ADP, Calcium Chloride, Magnesium Chloride, PEP, EDTA, ammonium acetate, sodium acetate buffer, dithiothreitol, PEG 4000, pH 4.8, VAPOR DIFFUSION, HANGING DROP, temperature 294K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 21 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Photon Factory Photon Factory  / ビームライン: BL-18B / 波長: 1 Å / ビームライン: BL-18B / 波長: 1 Å |
|---|---|
| 検出器 | タイプ: FUJI / 検出器: IMAGE PLATE / 日付: 1998年12月14日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→40 Å / Num. all: 41488 / Num. obs: 41488 / % possible obs: 78.3 % / Observed criterion σ(I): 0 / 冗長度: 2.84 % / Rsym value: 0.037 |
| 反射 | *PLUS 最低解像度: 10 Å / Rmerge(I) obs: 0.037 |
| 反射 シェル | *PLUS 最高解像度: 1.8 Å / 最低解像度: 1.86 Å / % possible obs: 69.4 % / Rmerge(I) obs: 0.45 / Mean I/σ(I) obs: 1.13 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1AQL 解像度: 1.8→10 Å / Isotropic thermal model: Isotropic / σ(F): 0 / 立体化学のターゲット値: Engh & Huber / 詳細: Simulated annealing
| |||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 29.6 Å2 | |||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→10 Å
| |||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 1.8 Å / 最低解像度: 10 Å / % reflection Rfree: 5 % / Rfactor Rfree: 0.22 / Rfactor Rwork: 0.18 | |||||||||||||||||||||
| 溶媒の処理 | *PLUS | |||||||||||||||||||||
| 原子変位パラメータ | *PLUS | |||||||||||||||||||||
| 拘束条件 | *PLUS
| |||||||||||||||||||||
| LS精密化 シェル | *PLUS 最高解像度: 1.8 Å / 最低解像度: 1.86 Å / Rfactor Rfree: 0.3 / Rfactor Rwork: 0.3 / Num. reflection obs: 2917 |
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj