+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1lsp | ||||||
|---|---|---|---|---|---|---|---|
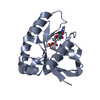
| タイトル | THE CRYSTAL STRUCTURE OF A BULGECIN-INHIBITED G-TYPE LYSOZYME FROM THE EGG-WHITE OF THE AUSTRALIAN BLACK SWAN. A COMPARISON OF THE BINDING OF BULGECIN TO THREE MURAMIDASES | ||||||
 要素 要素 | LYSOZYME | ||||||
 キーワード キーワード | HYDROLASE (O-GLYCOSYL) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報peptidoglycan catabolic process / lysozyme / lysozyme activity / killing of cells of another organism / defense response to Gram-positive bacterium / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  Cygnus atratus (コクチョウ) Cygnus atratus (コクチョウ) | ||||||
| 手法 |  X線回折 / 解像度: 2.45 Å X線回折 / 解像度: 2.45 Å | ||||||
 データ登録者 データ登録者 | Karlsen, S. / Rao, Z.H. / Hough, E. / Isaacs, N.W. | ||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.D / 年: 1996 ジャーナル: Acta Crystallogr.,Sect.D / 年: 1996タイトル: Structure of a bulgecin-inhibited g-type lysozyme from the egg white of the Australian black swan. A comparison of the binding of bulgecin to three muramidases. 著者: Karlsen, S. / Hough, E. / Rao, Z.H. / Isaacs, N.W. #1:  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: The Crystal Structure of a Complex between Bulgecin, a Bacterial Metabolite, and Lysozyme from the Rainbow Trout 著者: Karlsen, S. / Hough, E. #2:  ジャーナル: Aust.J.Biol.Sci. / 年: 1985 ジャーナル: Aust.J.Biol.Sci. / 年: 1985タイトル: Three-Dimensional Structure of Goose-Type Lysozyme from the Egg White of the Australian Black Swan, Cygnus Atratus 著者: Isaacs, N.W. / Machin, K.J. / Masakuni, M. #3:  ジャーナル: Tetrahedron / 年: 1984 ジャーナル: Tetrahedron / 年: 1984タイトル: Structures of Bulgecins, Bacterial Metabolites with Bulge-Inducing Activity 著者: Shinagawa, S. / Kasahara, F. / Wada, Y. / Harada, S. / Asai, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1lsp.cif.gz 1lsp.cif.gz | 52.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1lsp.ent.gz pdb1lsp.ent.gz | 36.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1lsp.json.gz 1lsp.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1lsp_validation.pdf.gz 1lsp_validation.pdf.gz | 656.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1lsp_full_validation.pdf.gz 1lsp_full_validation.pdf.gz | 668.8 KB | 表示 | |
| XML形式データ |  1lsp_validation.xml.gz 1lsp_validation.xml.gz | 8.4 KB | 表示 | |
| CIF形式データ |  1lsp_validation.cif.gz 1lsp_validation.cif.gz | 11.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ls/1lsp https://data.pdbj.org/pub/pdb/validation_reports/ls/1lsp ftp://data.pdbj.org/pub/pdb/validation_reports/ls/1lsp ftp://data.pdbj.org/pub/pdb/validation_reports/ls/1lsp | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 20434.172 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Cygnus atratus (コクチョウ) / 細胞内の位置: EGG WHITE / 参照: UniProt: P00717, lysozyme Cygnus atratus (コクチョウ) / 細胞内の位置: EGG WHITE / 参照: UniProt: P00717, lysozyme |
|---|---|
| #2: 化合物 | ChemComp-BUL / |
| #3: 水 | ChemComp-HOH / |
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.8 Å3/Da / 溶媒含有率: 55.99 % | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS pH: 6.5 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 波長: 1.5418 Å |
|---|---|
| 検出器 | タイプ: SIEMENS / 検出器: AREA DETECTOR / 日付: 1994年6月1日 |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | Num. obs: 6959 / % possible obs: 78.9 % / Observed criterion σ(I): 3 / Rmerge(I) obs: 0.055 |
| 反射 | *PLUS 最高解像度: 2.45 Å / 最低解像度: 32.94 Å |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2.45→8 Å / σ(F): 3 /
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.17 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.45→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj