登録情報 データベース : PDB / ID : 1ky7タイトル THE AP-2 CLATHRIN ADAPTOR ALPHA-APPENDAGE IN COMPLEX WITH AMPHIPHYSIN FXDXF ALPHA-ADAPTIN C AMPHIPHYSIN キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Mus musculus (ハツカネズミ)手法 / / 解像度 : 2.15 Å データ登録者 Brett, T.J. / Traub, L.M. / Fremont, D.H. ジャーナル : Structure / 年 : 2002タイトル : Accessory protein recruitment motifs in clathrin-mediated endocytosis.著者 : Brett, T.J. / Traub, L.M. / Fremont, D.H. 履歴 登録 2002年2月3日 登録サイト / 処理サイト 改定 1.0 2002年6月12日 Provider / タイプ 改定 1.1 2008年4月28日 Group 改定 1.2 2011年7月13日 Group 改定 1.3 2023年8月16日 Group / Database references / Refinement descriptionカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_ref_seq_dif Item / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  分子置換 / 解像度: 2.15 Å
分子置換 / 解像度: 2.15 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2002
ジャーナル: Structure / 年: 2002 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1ky7.cif.gz
1ky7.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1ky7.ent.gz
pdb1ky7.ent.gz PDB形式
PDB形式 1ky7.json.gz
1ky7.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1ky7_validation.pdf.gz
1ky7_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1ky7_full_validation.pdf.gz
1ky7_full_validation.pdf.gz 1ky7_validation.xml.gz
1ky7_validation.xml.gz 1ky7_validation.cif.gz
1ky7_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ky/1ky7
https://data.pdbj.org/pub/pdb/validation_reports/ky/1ky7 ftp://data.pdbj.org/pub/pdb/validation_reports/ky/1ky7
ftp://data.pdbj.org/pub/pdb/validation_reports/ky/1ky7 リンク
リンク 集合体
集合体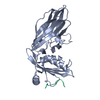
 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj













