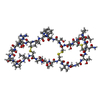
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1jjz | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | REFINED STRUCTURE AND DISULFIDE PAIRING OF THE KALATA B1 PEPTIDE | |||||||||
 要素 要素 | Kalata-B4 | |||||||||
 キーワード キーワード | PLANT PROTEIN / cyclic peptide / cyclotide / disulfide pairing / uterotonic | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Oldenlandia affinis (植物) Oldenlandia affinis (植物) | |||||||||
| 手法 | 溶液NMR / torsion angle dynamics | |||||||||
 データ登録者 データ登録者 | Skjeldal, L. / Gran, L. / Sletten, K. / Volkman, B.F. | |||||||||
 引用 引用 |  ジャーナル: Arch.Biochem.Biophys. / 年: 2002 ジャーナル: Arch.Biochem.Biophys. / 年: 2002タイトル: Refined structure and metal binding site of the kalata B1 peptide. 著者: Skjeldal, L. / Gran, L. / Sletten, K. / Volkman, B.F. #1:  ジャーナル: Biochemistry / 年: 1995 ジャーナル: Biochemistry / 年: 1995タイトル: Elucidation of the Primary and Three-Dimensional Structure of the Uterotonic Polypeptide Kalata B1 著者: Saether, O. / Craik, D.J. / Campbell, I.D. / Sletten, K. / Juul, J. / Norman, D.G. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1jjz.cif.gz 1jjz.cif.gz | 131.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1jjz.ent.gz pdb1jjz.ent.gz | 104.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1jjz.json.gz 1jjz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1jjz_validation.pdf.gz 1jjz_validation.pdf.gz | 338.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1jjz_full_validation.pdf.gz 1jjz_full_validation.pdf.gz | 450 KB | 表示 | |
| XML形式データ |  1jjz_validation.xml.gz 1jjz_validation.xml.gz | 14 KB | 表示 | |
| CIF形式データ |  1jjz_validation.cif.gz 1jjz_validation.cif.gz | 21.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/jj/1jjz https://data.pdbj.org/pub/pdb/validation_reports/jj/1jjz ftp://data.pdbj.org/pub/pdb/validation_reports/jj/1jjz ftp://data.pdbj.org/pub/pdb/validation_reports/jj/1jjz | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド | |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR |
|---|---|
| NMR実験 | タイプ: 2D NOESY |
| NMR実験の詳細 | Text: Structure was determined using NOEs from a single 100 ms mixing time NOESY experiment |
- 試料調製
試料調製
| 詳細 | 内容: 5 mM kalata B1; 90% H2O, 10% D2O / 溶媒系: 90% H2O/10% D2O |
|---|---|
| 試料状態 | イオン強度: 0 / pH: 3 / 圧: ambient / 温度: 298 K |
-NMR測定
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M |
|---|---|
| 放射波長 | 相対比: 1 |
| NMRスペクトロメーター | タイプ: Bruker DMX / 製造業者: Bruker / モデル: DMX / 磁場強度: 750 MHz |
- 解析
解析
| NMR software |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: torsion angle dynamics / ソフトェア番号: 1 詳細: Structures are based on a total of 333 distance constraints. This includes 6 upper and 6 lower limits defining 3 disulfide bonds, as well as 3 upper and 3 lower limits defining a peptide bond ...詳細: Structures are based on a total of 333 distance constraints. This includes 6 upper and 6 lower limits defining 3 disulfide bonds, as well as 3 upper and 3 lower limits defining a peptide bond cyclizing the peptide backbone. Residue numbering follows the original description of citation 1, except that for the purposes of structure calculations, the N-terminal residue was taken as Asn8. Therefore, residues 30-36 in this deposition correspond to residues 1-7 in citation 1 and related PDB entry 1kal. Structures were refined in the absence of any artificial constraints defining disulfide bonds until all NOEs had been assigned and low target functions were achieved (tf=0.6). 15 additional calculations were performed with these input data and the inclusion of constraints defining all possible disulfide pairing combinations. The structures containing disulfides between [5(34)-13], [17-29] and [22-27] displayed the lowest target function (0.74, second lowest was 1.54). On the basis of this result and analysis of NOEs observed between Cys sidechain protons, this disulfide bonding arrangement was assumed to be correct and served as the basis for this deposition. | ||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: target function / 計算したコンフォーマーの数: 50 / 登録したコンフォーマーの数: 20 |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj