+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1jcs | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | CRYSTAL STRUCTURE OF RAT PROTEIN FARNESYLTRANSFERASE COMPLEXED WITH THE PEPTIDE SUBSTRATE TKCVFM AND AN ANALOG OF FARNESYL DIPHOSPHATE | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE/TRANSFERASE INHIBITOR / FTASE / PFT / PFTASE / FT / FPT / FARNESYLTRANSFERASE / FARNESYL TRANSFERASE / FARNESYL PROTEIN TRANSFERASE / CAAX / RAS / CANCER / INHIBITOR / TRANSFERASE / transferase-transferase inhibitor complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Apoptotic cleavage of cellular proteins / Inactivation, recovery and regulation of the phototransduction cascade / RAS processing / protein geranylgeranyltransferase activity / peptide pheromone maturation / protein farnesylation / protein geranylgeranyltransferase type I / CAAX-protein geranylgeranyltransferase activity / CAAX-protein geranylgeranyltransferase complex / protein farnesyltransferase ...Apoptotic cleavage of cellular proteins / Inactivation, recovery and regulation of the phototransduction cascade / RAS processing / protein geranylgeranyltransferase activity / peptide pheromone maturation / protein farnesylation / protein geranylgeranyltransferase type I / CAAX-protein geranylgeranyltransferase activity / CAAX-protein geranylgeranyltransferase complex / protein farnesyltransferase / protein farnesyltransferase activity / protein farnesyltransferase complex / Rab geranylgeranyltransferase activity / regulation of fibroblast proliferation / protein geranylgeranylation / positive regulation of skeletal muscle acetylcholine-gated channel clustering / geranylgeranyl diphosphate synthase activity / microtubule associated complex / enzyme-linked receptor protein signaling pathway / positive regulation of Rac protein signal transduction / alpha-tubulin binding / positive regulation of cell cycle / wound healing / : / receptor tyrosine kinase binding / lipid metabolic process / positive regulation of fibroblast proliferation / microtubule binding / fibroblast proliferation / molecular adaptor activity / cell population proliferation / negative regulation of cell population proliferation / positive regulation of cell population proliferation / negative regulation of apoptotic process / zinc ion binding / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å | ||||||
 データ登録者 データ登録者 | Long, S.B. / Casey, P.J. / Beese, L.S. | ||||||
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2001 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2001タイトル: The crystal structure of human protein farnesyltransferase reveals the basis for inhibition by CaaX tetrapeptides and their mimetics. 著者: Long, S.B. / Hancock, P.J. / Kral, A.M. / Hellinga, H.W. / Beese, L.S. #1:  ジャーナル: Structure / 年: 2000 ジャーナル: Structure / 年: 2000タイトル: The Basis for K-Ras4B Binding Specificity to Protein Farnesyltransferase Revealed by 2A Resolution Ternary Complex Structures 著者: Long, S.B. / Casey, P.J. / Beese, L.S. #2:  ジャーナル: Science / 年: 1997 ジャーナル: Science / 年: 1997タイトル: Crystal Structure of Protein Farnesyltransferase at 2.25A Resolution 著者: Park, H.-W. / Boduluri, S.R. / Moomaw, J.F. / Casey, P.J. / Beese, L.S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1jcs.cif.gz 1jcs.cif.gz | 174 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1jcs.ent.gz pdb1jcs.ent.gz | 134.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1jcs.json.gz 1jcs.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1jcs_validation.pdf.gz 1jcs_validation.pdf.gz | 683.7 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1jcs_full_validation.pdf.gz 1jcs_full_validation.pdf.gz | 688.4 KB | 表示 | |
| XML形式データ |  1jcs_validation.xml.gz 1jcs_validation.xml.gz | 32.1 KB | 表示 | |
| CIF形式データ |  1jcs_validation.cif.gz 1jcs_validation.cif.gz | 47.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/jc/1jcs https://data.pdbj.org/pub/pdb/validation_reports/jc/1jcs ftp://data.pdbj.org/pub/pdb/validation_reports/jc/1jcs ftp://data.pdbj.org/pub/pdb/validation_reports/jc/1jcs | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||
| 単位格子 |
| ||||||||||
| 詳細 | The biological unit of protein farnesyltransferase (FTase) is a heterodimer of alpha and beta subunits. There is one FTase heterodimer per asymmetric unit. |
- 要素
要素
-PROTEIN FARNESYLTRANSFERASE, ... , 2種, 2分子 AB
| #1: タンパク質 | 分子量: 44098.145 Da / 分子数: 1 / 断片: ALPHA SUBUNIT / 由来タイプ: 組換発現 / 由来: (組換発現)  発現宿主:  参照: UniProt: Q04631, 転移酵素; メチル基以外のアルキル基またはアリル基を移すもの; - |
|---|---|
| #2: タンパク質 | 分子量: 48722.281 Da / 分子数: 1 / 断片: BETA SUBUNIT / 由来タイプ: 組換発現 / 由来: (組換発現)  発現宿主:  参照: UniProt: Q02293, 転移酵素; メチル基以外のアルキル基またはアリル基を移すもの; - |
-タンパク質・ペプチド , 1種, 1分子 C
| #3: タンパク質・ペプチド | 分子量: 728.942 Da / 分子数: 1 / 由来タイプ: 合成 / 詳細: NON-SUBSTRATE INHIBITOR |
|---|
-非ポリマー , 4種, 440分子 
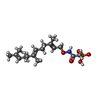





| #4: 化合物 | ChemComp-ZN / | ||
|---|---|---|---|
| #5: 化合物 | ChemComp-FII / [( | ||
| #6: 化合物 | | #7: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.13 Å3/Da / 溶媒含有率: 60.67 % | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 290 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.7 詳細: PEG 8000, Ammonium Acetate, DTT, Tris-HCl, pH 5.7, VAPOR DIFFUSION, HANGING DROP at 290K | ||||||||||||||||||||
| 結晶化 | *PLUS 温度: 17 ℃ | ||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 Å |
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE / 日付: 1999年5月17日 / 詳細: Mirrors |
| 放射 | モノクロメーター: Ni Filter / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2.2→50 Å / Num. all: 58693 / Num. obs: 55202 / % possible obs: 93.8 % / Observed criterion σ(I): 0 / 冗長度: 5.1 % / Biso Wilson estimate: 31.8 Å2 / Rmerge(I) obs: 0.067 / Net I/σ(I): 17.2 |
| 反射 シェル | 解像度: 2.2→2.23 Å / 冗長度: 4.98 % / Rmerge(I) obs: 0.269 / Mean I/σ(I) obs: 2.64 / Num. unique all: 1953 / % possible all: 100 |
| 反射 | *PLUS 最低解像度: 50 Å / Num. obs: 58693 / % possible obs: 99.7 % / Num. measured all: 207941 / Rmerge(I) obs: 0.088 |
| 反射 シェル | *PLUS 最高解像度: 2.2 Å / 最低解像度: 2.3 Å / Rmerge(I) obs: 0.47 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1D8D 解像度: 2.2→50 Å / Rfactor Rfree error: 0.004 / Data cutoff high absF: 10000000 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 2 / 立体化学のターゲット値: Engh & Huber / 詳細: Bulk solvent model used
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 34.5 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.2→50 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.2→2.3 Å / Rfactor Rfree error: 0.015 / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.851 / 分類: refinement X-PLOR / バージョン: 3.851 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS σ(F): 2 / % reflection Rfree: 5 % / Rfactor obs: 0.16 / Rfactor Rwork: 0.16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 34.5 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS Rfactor Rfree: 0.255 / % reflection Rfree: 5.1 % / Rfactor Rwork: 0.237 / Rfactor obs: 0.237 |
 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj







